Extrofia Vesical
Blake Palmer, Dominic Frimberger, Bradley Kropp
Universidad de Oklahoma
Traducido y editado desde el original al español | Enlace a la versión en inglés
Dra Pilar Echeverria, Dra Francisca Yankovic
Hospital Exequiel Gonzalez Cortes, Santiago Chile
La extrofia Vesical es una rara malformación genitourinaria cuyo manejo sigue siendo un desafío para el campo de la urología pediátrica. Definiéndola en términos simples, corresponde a una eversión de la vejiga hacia afuera del cuerpo (Figura 1).
Incidencia
La incidencia de extrofia vesical se estimaba originalmente entre 1:10.000 a 1: 50.000 recién nacidos vivos. Sin embargo, datos más recientes del International Clearinghouse for Birth Defects Monitoring System y del Healthcare Cost and Utilization Project Nationwide Inpatient Sample de Estados Unidos, han estimado su incidencia entre 1.15 y 3.3 por 100.000 recién nacidos vivos. Predomina en el sexo masculino en una relación de 2.3 - 6 : 1.
Embriología
El crecimiento del mesodermo entre las capas endodérmica y ectodérmica de la membrana cloacal bilaminar, resulta en la formación de la musculatura abdominal inferior y de los huesos pélvicos. Después del crecimiento interno del mesénquima, el septum o tabique uro rectal crece hacia caudal, dividiendo la cloaca en una porción anterior que formará la vejiga y una posterior que formará el recto. Los tubérculos genitales migran medialmente y se fusiona en la línea media cefálico a la membrana cloacal ubicada dorsalmente, antes de que ésta sea perforada. La membrana cloacal, puede ser objeto de ruptura temprana, dependiendo de la extensión del defecto infra umbilical. La etapa del desarrollo en que ocurra esta ruptura determina si el resultado será una extrofia de cloaca, una extrofia vesical o una epispadias.
La teoría más relacionada al desarrollo embriológico de la extrofia, sostenida por Marshal y Muecke, describe que se produce un sobre desarrollo anormal de la porción inferior de la membrana cloacal, lo que impide la migración medial de tejido mesenquimático. Por ello, no se produce un desarrollo adecuado de la pared abdominal. El momento de la ruptura de este defecto cloacal, determina la severidad de este trastorno. Perforaciones centrales dan origen a la extrofia clásica, lo que tiene mayor incidencia (60%), mientras que variantes de ésta dan cuenta de un 30% y la extrofia de cloaca de un 10% de este complejo malformativo.
Otras teorías relativas al complejo extrofia - epispadias han sido propuestas:
Ambrose y O´Brian postularon que un desarrollo anormal de las prominencias genitales, con fusión de éstas en la línea media por debajo en vez de sobre la membrana cloacal, resulta en el defecto característico de la extrofia.
Otra hipótesis describe una inserción anormalmente caudal del tallo corporal, con falla en la interposición del tejido mesenquimático en la línea media. Como resultado de esta falla, la translocación de la cloaca hacia la profundidad de la cavidad abdominal no se produce. La membrana cloacal entonces, permanece en una posición infraumbilical superficial, lo que representa un estado embrionario inestable con gran tendencia a desintegrarse.
Ninguna teoría parece dilucidar todos los aspectos clínicos vistos en este complejo y estudios adicionales se llevan a cabo para describir completamente los procesos del desarrollo que finalmente producen el complejo extrofia - epispadias.
Herencia
Existe evidencia de predisposición genética para extrofia y epispadias. El riesgo de recurrencia de extrofia vesical en una familia es aproximadamente 1%, mucho mayor que en la población general. Existen muchos reportes de gemelos con extrofia. Hay numerosos trabajos en gemelos idénticos que reportan extrofia en ambos, sin embargo, hay otros que reportan extrofia sólo en uno de los gemelos. Hay numerosos casos de gemelos no idénticos, en que sólo uno de ellos está afectado. Estos hallazgos se han encontrado tanto en hombres como mujeres. Además, análisis de concordancia de gemelos con complejo extrofia vesical - epispadias sugieren una etiología genética.
La probabilidad de un padre con extrofia de tener un hijo con extrofia es alrededor de 1: 70 recién nacido vivos, es decir, 500 veces mayor que la población general.
Se ha hecho muchos esfuerzos para entender las posibles etiologías del complejo extrofia - epispadias. Se ha postulado que el desarrollo temprano de un medio hormonal asociado a fertilización in vitro, se relaciona con un incremento hasta de 7,5 veces de la tasa de nacimientos con complejo extrofia - epispadias, en mujeres que se sometieron a este procedimiento. Por otra parte, el gen CASPR3 del cromosoma 9, ha sido implicado en el complejo extrofia - epispadias por Boyadjiev y cols. Otro set de genes del cromosoma 9 ha sido asociado con extrofia vesical. Estudios están intentando identificar factores genéticos específicos que se puedan asociar al complejo extrofia - epispadias. Hay otros posibles locus de genes se han identificado, pero no confirmado.
Diagnóstico Prenatal
Pese a la magnitud del defecto en la pared abdominal inferior y en el desarrollo de los órganos pélvicos, es todavía difícil hacer un diagnóstico certero mediante la ecografía prenatal. Esto es por su rara incidencia y frecuentemente esta malformación es confundida con onfalocele o gastrosquisis. Varios grupos han ilustrados los hallazgos ecográficos importantes en el diagnóstico prenatal de extrofia vesical. En una revisión de 25 ecografías de pacientes que resultaron nacer con extrofia vesical clásica, Gearhart y cols. describieron los principales criterios para el diagnóstico prenatal de extrofia:
- Ausencia de llene vesical
- Masa en abdomen inferior, que se hace más protuberante a medida que avanza el embarazo
- Baja inserción del cordón umbilical
- Separación de las ramas del pubis
- Dificultad en determinar el sexo del feto
Analizando estos datos, siempre que no se logre visualizar la vejiga, se debe sospechar extrofia vesical.Se cree que el ultrasonido 3D y el aumento del uso de resonancia magnética fetal, mejorará la posibilidad de diagnóstico prenatal de extrofia vesical y de extrofia cloacal. Esto permite el enfoque multidisciplinario por equipos que tengan experiencia en el manejo del complejo extrofia - epispadias. Esto incluye la disponibilidad de equipos de cirugía reconstructiva en el periodo de recién nacido y de apoyo psico social para los padres y la familia de estos pacientes.
El diagnóstico de extrofia vesical se realiza (o confirma) al nacer con la visualización de la placa vesical protruyendo en forma característica bajo el cordón umbilical con músculos rectos abdominales divergentes, que se dirigen hacia los huesos púbicos ampliamente separados.
Defectos esqueléticos
El defecto óseo más evidente es la separación de los huesos del pubis, lo que es causado por rotación externa de los huesos innominados, eversión y acortamiento de aproximadamente un 30% de las ramas de pubis. La tomografía axial (TAC) con reconstrucción 3D, ha podido determinar que el promedio de rotación del aspecto posterior de la pelvis es de 12% a cada lado y el de rotación de la pelvis anterior es de 18º. Además, se observa retroversión del acetábulo y se muestra que el ángulo de la articulación sacro ilíaca (antes del cierre) fue 10º mayor y 10º más hacia el plano coronal que al sagital en la pelvis de pacientes con extrofia que en controles de la misma edad. Junto con ello, la pelvis ósea presenta una rotación inferior de 14,7º. El sacro es 42,6% más grande según la volumetría calculada y tiene una superficie 23.5% mayor. Estas deformidades de los huesos pelvianos contribuyen al acortamiento del falo, marcha de pato y rotación externa de las extremidades inferiores en pacientes con extrofia.
Un estudio de 299 niños con extrofia vesical indica que los pacientes portadores de extrofia vesical pueden presentar variaciones vertebrales: espina bífida oculta, lumbarización o sacralización de vértebras en 11%, escoliosis no complicada en 2.7% y disrrafia espinal en 4%, incluyendo mielomeningocele, lipomeningocele, sacro en cimitarra y hemivértebras.
Defectos del Piso Pélvico
Datos de Stec y cols. usando imágenes de TAC con reconstrucción 3D, demuestran que, en los pacientes con extrofia vesical clásica, el haz puborrectal soportan hasta dos veces más cavidad corporal que controles a la misma edad.Mientras el grupo muscular elevador se distribuye de manera homogénea hacia anterior y posterior del recto en grupos controles (52 y 48%), en el grupo de pacientes con extrofia, lo hace de manera desigual siendo mayor la proporción hacia posterior (68 y 32%). También hay un significativo aplanamiento de los elevadores. Además se ha visto una disminución de 31.7º en la inclinación entre la mitad derecha e izquierda del elevador del ano y haz puborrectal.Como consecuencia, el ano se ubica en posición anterior y en algunas oportunidades en forma patológica como parte de la extensión posterior del defecto miofascial.Estas alteraciones esqueléticas explican la alta tasa de prolapso rectal, especialmente en la población femenina con extrofia.
Se han realizado estudios del piso pélvico con resonancia magnética 3D y éstos han tenido un impacto en la comprensión de la pelvis de la extrofia para su reconstrucción. Williams y cols. demostraron que el grupo muscular del elevador del ano tenía menos cúpula y era más irregular en los pacientes con extrofia que en controles, previo al cierre. Además, se concluyó que no hay relación entre el grado de diástasis del pubis y la magnitud de la desproporción de la curvatura del grupo muscular del elevador del ano. La evaluación con resonancia magnética posterior al cierre quirúrgico de la pelvis ha mostrado que en los pacientes que logran algún grado de continencia, la distancia intrasínfisis es más corta, el ángulo de divergencia del elevador del ano es más agudo y el cuello vesical queda más profundamente posicionado en la pelvis. Gargollo estudió con resonancia magnética pre y postoperatoria a los pacientes, reportando que el ángulo puborrectal en aquellos con continencia, había disminuido en la imagen postoperatoria.Nuevos estudios del uso de ecografía perineal 3D para evaluar el piso pélvico de mujeres adultas con antecedentes de extrofia, reportan una buena correlación con imágenes de resonancia magnética.
Estos estudios refuerzan la necesidad de disección agresiva para posicionar lo más posterior posible a la vejiga y a la uretra posterior, además de lograr buena aproximación del pubis al momento del cierre. Si la reconstitución no se realiza en periodo de recién nacido, se puede requerir osteotomías y fijación pélvica.
Defectos de la Pared Abdominal
Como resultado de la ruptura anormal de la membrana cloacal en la pared abdominal, queda un defecto triangular, que es ocupado por la vejiga extrófica y la uretra posterior. Este defecto en la fascia está limitado inferiormente por una banda intra sinfisiaria, que representa el diafragma urogenital divergente y conecta el cuello de la vejiga y la uretra posterior a las ramas del pubis. Wakim y Barbet investigaron la relación entre el la fascia y el músculo recto abdominal con el diafragma urogenital y no encontraron evidencia macroscópica ni histológica de esfínter uretral. Sí encontraron musculatura vesical extendiéndose lateralmente al pubis, donde se inter digitaban con fibras de la fascia del recto para formar el diafragma urogenital fibroso. La importancia de incidir completamente estas fibras laterales a la placa uretral hasta el nivel de las ramas púbicas inferiores y del hiato de los elevadores, para lograr una posición lo más profunda posible en la pelvis de la vejiga y la uretra posterior, fue demostrada por Gearhart y cols., usando datos de cierres de cloacas fallidos cuando estas fibras estaban intactas al momento de re operar a los pacientes.Hacia cefálico, el límite del defecto fascial es el ombligo. La distancia entre el ombligo y el ano está acortada en la extrofia vesical, ya que el ombligo está muy por debajo de la línea horizontal de las crestas iliacas. Pese a que la hernia umbilical es un hallazgo frecuente, ésta suele ser de un tamaño insignificante y se repara en el momento del cierre inicial de la extrofia.
Las hernias inguinales son frecuentes. Se deben a la carencia de oblicuidad del canal inguinal, asociado a grandes anillos inguinales interno y externo y a persistencia del proceso peritoneo vaginal. Connolly y cols. reportaron una incidencia de 81.8% en hombres y de 10,5% en mujeres. Es importante explorar los canales inguinales al momento del cierre de la extrofia y resecar el saco herniario reparando la fascia transversalis y el defecto muscular para prevenir recurrencia o hernias directas.
Defectos Ano rectales
El periné de los pacientes con extrofia es corto y ancho. El ano está inmediatamente detrás del diafragma urogenital. Está desplazado hacia anterior y constituye el límite posterior del defecto triangular de la fascia. El complejo esfinteriano del ano también está desplazado hacia adelante y debe ser preservado intacto. Estos factores anatómicos contribuyen a diferentes grados de incontinencia y prolapso rectal. El prolapso ocurre frecuentemente en pacientes no tratados con gran separación de la sínfisis pubiana. Usualmente es transitorio, fácil de reducir y desaparece después de el cierre de la vejiga o de la derivación vesical o urinaria. La aparición de prolapso rectal es además una indicación de cirugía definitiva de la extrofia vesical. Si aparece después de la cirugía de cierre de la extrofia, se debe sospechar obstrucción de la uretra posterior o de la vejiga y se debe realizar inmediatamente una evaluación del tracto de salida, mediante cistoscopia.
Alteraciones genitales en hombres
Las alteraciones genitales asociadas a extrofia en el hombre son severas y desafiantes al momento de la reconstrucción. El falo es corto, debido a un déficit de un 50% en la longitud de los cuerpos cavernosos anteriores, con preservación de la longitud corporal posterior cuando se compara con controles de la misma edad con resonancia magnética. El diámetro del segmento corporal posterior es mayor que en el grupo control. La diástasis de la sínfisis del pubis incrementa la distancia intrasinfisiaria, pero el ángulo entre los cuerpos cavernosos no se altera, ya que los cuerpos están separados paralelamente. Esto produce un pene que impresiona corto por la diástasis y la deficiencia congénita de tejido corporal anterior. Liberando la cuerda dorsal, alargando la placa uretral y movilizando la crura en la línea media para alargar un poco el pene, puede resultar en un falo funcional y cosméticamente aceptable.
Gearhart y cols. Usaron resonancia magnética para demostrar en 13 adultos hombres con extrofia vesical, que el volumen, peso y área de sección máxima de la próstata es normal comparado con controles. Sin embargo, encontraron que, en ninguno de los pacientes, la próstata rodea completamente la uretra, y que la uretra fue anterior a la próstata en todos los pacientes. Los niveles de Antígeno Prostático Específico (APE) libre y total en adultos con extrofia resultaron ser medibles, pero bajo los límites establecidos para la edad de hombres normales. Hay un caso de un hombre de 52 años, con antecedentes de epispadias, que tuvo cáncer de próstata con APE de 4,2 al momento de la biopsia.
El conducto deferente y eyaculador son normales en pacientes con extrofia en la medida que no sean dañados iatrogénicamente durante el cierre. El promedio del largo de las vesículas seminales se ha visto que es normal.
La inervación automómica de los cuerpos cavernosos (nervios cavernosos), está desplazada lateralmente en los pacientes con extrofia y son preservados en prácticamente todos lo pacientes después de la cirugía. Es frecuente la eyaculación retrógrada después del cierre vesical y de la reconstrucción del cuello.
Los testículos tienden a ser retráctiles, pero tienen adecuada longitud del cordón espermático, el que alcanza el escroto ancho y plano sin necesidad de orquidopexia. No se ha estudiado los testículos en series grande de pacientes postpuberales con extrofia, pero se cree que no están alterados. D´Hauwers y cols. reportaron el uso de aspiración de espermatozoides percutánea e inyección intracitoplasmática de éstos en 3 pacientes con extrofia con éxito.
Alteraciones genitales en mujeres
En mujeres, el clítoris y los labios están separados y el orificio vaginal está desplazado anteriormente y es estenótico. El clítoris es bífido y la vagina es más corta que en los controles, pero de calibre normal. El cuello uterino se encuentra en la pared vaginal anterior, porque el útero entra en la vagina superiormente. Los ovarios y las tubas uterinas son normales.El clítoris bífido debe ser aproximado a losextremos de los labios menores para formar la horquilla, al momento del cierre primario.
Frecuentemente, se requiere dilatación vaginal o episiotomía para permitir relaciones sexuales satisfactorias en la mujer adulta. Un estudio en 56 mujeres adultas encontró que 10 desarrollaron prolapso uterino a un promedio de edad de 16 años. 6 de ellas habían tenido una reconstrucción previa que incluía osteotomía a una edad promedio de 2.1 años.
Defectos Urinarios
La vejiga expuesta es susceptible de experimentar cambios quísticos o metaplasia, por lo tanto debe ser irrigada frecuentemente con solución salina y protegida con alguna membrana del trauma que pudiera ocasionar el roce y la exposición, hasta que se pueda llevar a cabo el cierre. Habitualmente una envoltura plástica es suficiente. Al nacimiento, la mucosa puede tener mucosa intestinal ectópica, un asa intestinal aislada o más comúnmente, pólipos hamartomatosos.
Shapiro y Cols. caracterizaron la función muscular de la vejiga. Ellos evidenciaron que la densidad de receptores colinérgicos muscarínicos y su afinidad con los neurotransmisores era similar a los grupos control. Biopsias de vejiga de 12 recién nacidos con extrofia vesical comparadas con grupos control de la misma edad, mostraron que la relación entre colágeno y músculo liso era mayor en las vejigas extróficas. El tipo de colágeno fue analizado, encontrándose una distribución normal de colágeno tipo I, pero el tipo III resultó estar aumentado en tres veces. Posteriormente se vio que, pacientes con crecimiento vesical demostrado, que evolucionaron libre de episodios de infección, tenían una marcada disminución de la relación entre colágeno y músculo liso. Cultivos primarios de células de músculo liso de vejigas extróficas, mostraron tener características de crecimiento similares a las reportadas para células de vejigas sin extrofia, evidenciando que ellas mantienen el potencial de crecimiento y función. Mathews y Cols. encontraron que el número promedio de fibras nerviosaspequeñas mielinizadas por campo era significativamente menor en vejigas extróficas, comparadas con controles. Al mismo tiempo, se vio preservación de fibras nerviosas más grandes, lo que llevó al estudio a hipotetizar que la extrofia vesical en recién nacidos representa vejigas en un estado de desarrollo más precoz. Múltiples marcadores inmunocitoquímicos e histoquímicos, polipéptido intestinal vasoactivo (VIP), neuropéptido Y (NYP), sustancia P (SP), producto relacionado con el gen de calcitonina (CGRP), producto genético de proteína (PGP) 9.5 y diaforasa nicotinamida adenina dinucleótido fosfato (NADPHd) han sido estudiadas, y no hay evidencia morfológica de desinervación de la musculatura vesical en ningún caso de extrofia vesical. Sin embrago, casos de extrofia vesical con reconstrucción fallida si mostraron deficiencias en la inervación de la musculatura, asociado a incremento en la inervación sub e intraepitelial. El microanálisis de formación de músculo liso en vejigas extróficas comparadas con controles sanos, mostró que al parecer existe una inmadurez del desarrollo de el músculo liso vesical. Por lo anterior, queda la sensación de que, pese a que la vejiga de los pacientes con extrofia pese a que puede ser inmadura, tiene el potencial de desarrollo normal después de un cierre inicial exitoso.
Dos tipos de pólipos fueron encontrados en la placa vesical, con hallazgos sobrepuestos: fibróticos y edematosos. Ambos están asociados a metaplasia escamosa suprayacente en el 50% de los casos. Grados variables de nidos de Von Brunn, cistitis quística y cistitis glandular fueron notados también. Un mayor porcentaje de esta última se encontró en los casos de cierre secundario. Se ha recomendado vigilancia a largo plazo de los pacientes con cistitis glandulares, dado el potencial riesgo de adenocarcinoma. Esta se puede realizar con citología y cistoscopia al entrar en la adultez.
Al momento del nacimiento, la placa vesical puede invaginarse o abultarse a través de un defecto fascial pequeño, pero la verdadera estimación de la placa no se puede realizar hasta que el paciente se encuentra completamente relajado bajo anestesia general. Una vejiga pequeña, fibrosa, sin elasticidad y/o cubierta de pólipos, puede hacer muy desafiante y potencialmente imposible una reparación funcional.
En un grupo de pacientes con extrofia continentes, se obtuvieron entre un 70 - 90% de cistogramas normales. Una revisión de 30 pacientes con extrofia en distintas fases de la actual reparación por etapas previo a la reconstrucción del cuello vesical encontró que un 80% de las vejigas fueron complacientes y estables después de la reconstrucción cervical. Aproximadamente la mitad mantiene esta acomodación vesical normal, aunque menos mantienen la estabilidad vesical normal. La sensación de los autores fue que un 25% de los pacientes con extrofia puede mantener función de detrusor normal después de la reconstrucción
El resto del tracto urinario es usualmente normal, pero pueden existir anomalías. Se pueden encontrar riñones en herradura, riñones pélvicos, monorrenos y displasias renales asociadas a megaureteres. El trayecto de los ureteres en su porción distal es anormal, ya que el saco de Douglas entre la vejiga y el recto está alongado y usualmente es profundo, por lo que el trayecto de los ureteres en la pelvis verdadera está lateralizado y su segmento distal, se aproxima a los meatos desde abajo y lateral. Por ello el 100% de los casos de extrofia vesical presentan reflujo vesicoureteral. El reimplante ureteral se realiza al mismo tiempo de la reconstrucción del cuello vesical, aunque a cuando hay infecciones, excesiva resistencia al vaciamiento vesical o problemas en el tracto urinario superior derivados de reflujos severos, puede ser necesario hacerlo antes.
Evaluación y Manejo al Nacimiento
En la sala de partos, el cordón umbilical debe ser ligado con seda 2.0 cerca a la pared abdominal para que el clamp umbilical no irrite o traumatice la mucosa vesical. La mucosa vesical debiera ser frecuentemente irrigada con suero fisiológico tibio y siempre cubierta con una envoltura de plástico transparente protectora, hasta el cierre. Se recomienda irrigar la vejiga y cambiar el plástico en cada muda.
Es importante un enfrentamiento multidisciplinario. El equipo debiera incluir, pero no estar limitado a, un urólogo pediátrico, cirujano ortopedista pediátrico, anestesiólogo pediátrico, neonatolólogo, fisiatra pediátrico (con experiencia en anomalías genitales) y trabajadores sociales. Estudios han demostrado que los padres de los pacientes con extrofia vesical experimentan una significativa cantidad de stress, el que no debe ser pasado por alto durante los cuidados iniciales y a largo plazo del paciente. Deben ser reforzada la idea de que los niños con extrofia clásica son en generalmente sanos, robustos y con perspectivas de una vida normal. Es posible una reconstrucción efectiva para permitir el almacenamiento, vaciado y control urinario, que además sea cosméticamente aceptable. El apoyo de psicólogos, enfermeras y de padres de otros niños con extrofia es de mucho valor y está disponible en la Asociación de Niños con Extrofia Vesical, cuyo sitio web (www.bladderextrophy.com) ofrece más información a los padres y familiares.
Los neonatólogos deben evaluar al paciente desde el punto de vista cardiopulmonar y pediátrico general, considerando la posibilidad de una cirugía mayor dentro de las primeras 48 horas de vida. Comúnmente se realiza un ecocardiograma para descartar anomalías cardiopulmonares significativas que pudieran imposibilitar una reconstrucción temprana. Se debiera contar también con una ecografía renal para el tracto urinario superior. Una radiografía renal y vesical simplese debe realizar para evaluar la anatomía de los huesos pelvianos y una ecografía de columna se requiere para descartar disrrafia espinal.
Es esencial que un cirujano pediatra genitourinario con experiencia e interés en el complejo extrofia - epispadias evalúe al recién nacido con extrofia, ya que el pronóstico de esta malformación congénita es significativamente peor con un inadecuado manejo inicial.
Como muchos de estos casos no tienen diagnóstico antenatal, deben ser trasladados al nacer a un centro especialista en extrofia. Durante el viaje, la delicada mucosa vesical debe ser mantenida húmeda y protegida con una membrana plástica transparente.
Reconstrucción Quirúrgica
Los objetivos de la reconstrucción quirúrgica en el paciente con extrofia son corregir los defectos urogenitales proporcionando un reservorio adecuado para el almacenamiento urinario a bajas presiones con la capacidad de vaciarse completamente sin comprometer la función renal, crear genitales externos funcionales y estéticamente aceptables y maximizar calidad de vida del paciente.
Los intentos tempranos de reparación de la extrofia vesical no tuvieron éxito y los pacientes tenían una esperanza de vida limitada. Por lo tanto, durante muchos años el manejo de la extrofia consistió en la extirpación de la vejiga extrófica y la derivación urinaria, comúnmente mediante uretero sigmoidostomía. Las reparaciones por etapas comenzaron a mostrar un éxito temprano en la década de 1950. En la década de 1970, se iniciaron las reconstrucciones por etapas similares a las que se utilizan hoy en día. Esto modernizó la reparación de la extrofia vesical con técnicas que se usan comúnmente en la actualidad. A fines de la década de 1980, se inició un enfoque anatómico para la reparación de la extrofia, que se ha modificado en lo que ahora se conoce como la reparación primaria completa de la extrofia o la técnica de Mitchell.
En la actualidad, la mayoría de los pacientes se tratan con una reparación primaria completa de la extrofia (CPRE) o con una reconstrucción por etapas moderna de la extrofia (MSRE). Aún es tema de debate el tratamiento óptimo de la extrofia en el período neonatal. Teniendo esto en cuenta, la ureterosigmoidostomía sigue siendo una reconstrucción utilizada en algunas partes del mundo porque de manera confiable logra la continencia urinaria y es relativamente segura para quienes no tienen acceso a instalaciones de atención médica complejas o centros especializados de extrofia.
Reparación primaria completa de la extrofia (CPRE)
El CPRE es el desarrollo más reciente en el manejo quirúrgico de los pacientes de extrofia pionero por el Dr. Mitchell. Este enfoque ha sido adoptado y reproducido por múltiples centros de excelencia para el cuidado de pacientes con extrofia. En el CPRE, el enfoque anatómico para la reconstrucción incluye el cierre de la vejiga con remodelación del cuello de la vesical y una técnica de desmontaje para la reparación de la epispadias con o sin osteotomías. Se considera que esto permite ciclar la vejiga y un crecimiento y desarrollo más "normal" porque la vejiga experimenta una resistencia al tracto de salida. La técnica de desmontaje para la reparación de epispadias también permite la división de los ligamentos inter sinfisarios y la colocación anatómica del cuello de la vejiga y la uretra posterior en la pelvis, su posición ortotópica. Cuando se realiza dentro de las primeras 72 horas de vida, la pelvis es lo suficientemente maleable para cerrarse sin osteotomías. Los pacientes necesitan la tracción de Bryant durante aproximadamente 1 semana y luego una tracción de las extremidades inferiores durante 3 semanas para evitar la tensión en el cierre de la pelvis. La incidencia de dehiscencia y prolapso de la vejiga es rara en la actualidad.
La CPRE se recomienda como un enfoque para permitir el desarrollo máximo de la vejiga nativa y definir a aquellos pacientes cuyas vejigas crecerán y se desarrollarán. La normalización de la anatomía en el cierre inicial justo después del nacimiento puede tener otros beneficios, como minimizar el trauma psicosocial de la familia. Los pacientes cuya vejiga sí se desarrolla, probablemente se someterán a menos procedimientos que en aquello en que se realiza el cierre por etapas.
Se ha informado que la continencia social después de la CPRE es del 76%, definida como intervalos secos de más de 2 horas y micción espontánea sin cateterización. Sin embargo, es probable que un porcentaje significativo de pacientes requiera un procedimiento formal en el cuello vesical para lograr la continencia . En otra serie, el 75% de los pacientes después de la CPRE fueron continentes con intervalos de 4 horas y secos por la noche, y un 31,3% que requirieron cateterismo limpio intermitente.
Los problemas relacionados con la CPRE guardan relación con el potencial deterioro de la función renal relacionado con un sistema urinario al que se le aumenta la presión de salida, el riesgo de lesión o pérdida del pene con el desmontaje a una edad tan temprana, y la frecuente necesidad de múltiples procedimientos a pesar del nombre "reparación completa". El seguimiento cercano del tracto urinario superior es importante en la extrofia, independientemente del tipo de reparación. La hidronefrosis, la pielonefritis y la aparición de cicatrices renales se observan después de la CPRE y deben tratarse de manera agresiva. Es recomendable el uso de antibióticos profilácticos, ya que se espera un reflujo vesicoureteral postoperatorio. El seguimiento a largo plazo en la serie de Seattle muestra una porcentaje de hidronefrosis leve (45%), moderada (17.8%) y severa (7.1%) después de la CPRE. Sin embargo, cerca de la mitad de los pacientes con hidronefrosis, y en todas con hidronefrosis leve, esta fue de carácter transitoria. Borer y colaboradores informaron una incidencia de pielonefritis del 28% y la aparición de cicatrices renales por DMSA del 19% después de la CPRE. En cerca de un tercio de los pacientes se efectuará un reimplante ureteral bilateral al momento de la cirugía del cuello vesical.
Aproximadamente el 36-68% de los pacientes quedarán con hipospadias después de la CPRE que requerirán una cirugía peneana adicional. La necrosis del glande, la pérdida de la piel del pene y / o la pérdida de tejido del pene se han reportado después de la CPRE, pero son complicaciones bastante infrecuentes cuando el procedimiento se realiza en un centro de excelencia de extrofia.
La comparación de la cantidad de procedimientos que se espera que un paciente se realice cuando se compara la CPRE y la MSRE, es un tema controvertido. Los informes varían ampliamente en cuanto a la cantidad y los tipos de procedimientos, y los informes pueden tener sesgos, lo que dificulta la extracción de conclusiones verdaderas sobre este tema. Sin embargo, se acepta que los pacientes manejados con un enfoque de CPRE y MSRE probablemente requerirán múltiples procedimientos y los resultados son mejores si se manejan en un centro de excelencia para la extrofia.
Reconstrucción escalonada moderna de la extrofia (MSRE)
La MSRE actual ha evolucionado del trabajo original de Cendron y Jeffs. El grupo Hopkins, liderado por el Dr. Gearhart, actualmente tiene la mayor cantidad de pacientes con extrofia y escribe la mayoría de la literatura sobre la MSRE. En la MSRE, el objetivo de la reconstrucción inicial es convertir la vejiga extrófica en una epispadias completa. Las osteotomías pélvicas se realizan junto con el cierre de la vejiga cuando está indicado. Se considera que esto permitirá la protección contra la disfunción renal porque el paciente todavía tiene incontinencia, pero también puede estimular el crecimiento de la vejiga, ya que ahora existe cierta resistencia a la salida de la vejiga. La reparación de las epispadias se realiza entre los 6 y los 12 meses de edad y se puede realizar una estimulación con testosterona antes de la operación. Las reparaciones del cuello de la vejiga para la continencia se realizan entre los 4 y los 5 años si la capacidad vesical es adecuada, determinando si podrá realizar un programa de rehabilitación miccional en el post operatorio. Si no se cumplen estos criterios, se deja incontinente al paciente hasta que la vejiga crezca y el paciente esté más maduro para ofrecer tal vez un canal cateterizable y/o ampliación vesical y/o cierre del cuello de la vejiga cuando sea necesario.
Las tasas de continencia son reportadas por Gearhart en varones, como cercana al 70% y de un 74% en mujeres, con períodos secos de más de 3 horas con micción espontánea y seco durante la noche sin CLI. Se ha llegado a la conclusión de que una capacidad vesical de 100 ml o más predice el éxito en el momento de la reconstrucción del cuello vesical utilizando la reparación de Young-Dees-Leadbetter modificada. Si no se alcanza la capacidad de 100 ml, se considera que deben someterse a una cistoplastía de aumento en el momento de la reconstrucción para la continencia. También encontraron que las mujeres eran más propensas a lograr continencia y en forma más rápida después de la reconstrucción del cuello vesical. Los informes también muestran tasas de complicaciones bajas. En los varones después del cierre, la epispadias y la reconstrucción del cuello vesical, la tasa total de complicaciones fue del 41,7%. En mujeres después del cierre de la vejiga y la reconstrucción del cuello vesical, la tasa total de complicaciones fue del 19,5%. En su serie moderna, si se produce un crecimiento exitoso de la vejiga, el 19,4% de los hombres y el 17% de las mujeres fracasarán después de la reconstrucción del cuello vesical y requerirán probablemente de una cistoplastía de aumento, un estoma cateterizable y/o un cierre del cuello de la vejiga.
En la MSRE, si la capacidad de la vejiga de un paciente no se desarrolla al nivel que predice el éxito en la reconstrucción del cuello vesical, el paciente pasa directamente a una cirugía de aumento. Debido a que la CPRE realiza un procedimiento de continencia en el cierre inicial, incluyen a aquellos pacientes cuyas vejigas pueden no haberse desarrollado y nunca han sido candidatos para una reconstrucción del cuello de la vejiga si hubieran sido tratados por MSRE. Además, es difícil determinar cuántas de las vejigas, si las hay, que no se desarrollaron a 100 ml de capacidad por continencia hubieran crecido si hubieran tenido una CPRE al cierre inicial con una mayor resistencia de salida. También puede haber un cierto subconjunto de vejigas de extrofia que son "malas" y no crecerán independientemente de la técnica de cierre, pero no pueden ser identificadas al nacer. Estos factores hacen que sea difícil definir el éxito y el fracaso al comparar técnicas. El análisis prospectivo adicional a largo plazo debe continuar de forma imparcial y abierta para promover el intercambio de ideas que, con suerte, puede conducir a los próximos avances en el manejo de la extrofia que continuarán mejorando la calidad de vida de estos pacientes.
Resumen de los acuerdos en la reconstrucción quirúrgica de la extrofia vesical
- El manejo debe hacerse en un centro de excelencia y con un equipo multidisciplinario.
- La placa de la vejiga debe estar húmeda y cubierta con envoltura de plástico después del nacimiento hasta el cierre
- El cierre primario exitoso temprano es primordial para lograr la continencia
- Las osteotomías son necesarias si el cierre se realiza después de las 72 horas de vida
- El seguimiento del trato urinario superior es importante después del cierre de la vejiga
- Se requieren múltiples procedimientos para lograr la continencia y reconstrucción de la anatomía.
- La cistoplastía de aumento con o sin estoma cateterizable y el cierre del cuello de la vejiga puede ser necesario en aquellos que no logran la continencia
Función sexual en el paciente de extrofia
Hay informes de pacientes adultos con extrofia masculina que son padres o que inician un embarazo, lo que muestra que la fertilidad es posible en estos pacientes, aunque no es lo más común. La gran serie de Shapiro de 2500 pacientes sólo documentó a 38 varones que habían sido padres. Los estudios de análisis de semen que compararon a hombres que se sometieron a una reparación primaria a una derivación de ureterosigmoidostomía encontraron un recuento normal de espermatozoides en sólo uno de ocho en el grupo de cierre y en cuatro de ocho en el grupo derivado. Estas diferencias se atribuyeron a la eyaculación retrógrada y la lesión iatrogénica durante el cierre funcional de la vejiga. Otro estudio encontró que ninguno de sus pacientes reconstruidos podía eyacular normalmente, ni habían tenido hijos. Cinco pacientes que no se habían sometido a una reconstrucción tenían una eyaculación normal y dos tenían hijos. Esto lleva a la conclusión de que el paciente masculino tiene un alto riesgo de infertilidad después de la reconstrucción. Bastuba y sus colaboradores han demostrado que el uso de la reproducción asistida puede ser exitoso en los pacientes con extrofia.
Woodhouse informó que la función sexual y la libido del paciente con extrofia es normal. Varios informes muestran que la función eréctil se mantiene en una gran mayoría de los pacientes después de la reconstrucción uretral y fálica, y que la eyaculación a menudo no es normal, pero suele estar presente. La mayoría informó sobre orgasmos satisfactorios y describió las relaciones íntimas como serias y de largo plazo.
Los genitales externos femeninos ahora se reconstruyen de manera rutinaria en el momento del cierre de la extrofia. Anteriormente, esta reconstrucción consistía en una aproximación estética del clítoris bífido y los labios anteriores para formar una horquilla, pero no abordó la anomalía anatómica inherente de la ubicación y el ángulo de la vagina en relación con el abdomen y el periné en mujeres con extrofia. La reconstrucción posterior durante la adolescencia, antes del inicio de la actividad sexual o el uso de tampones para dilatar la vagina en algunas pacientes con extrofia femenina, no era infrecuente. Se puede utilizar la movilización del complejo urogenital total, lo que resulta en una corrección exitosa de la ubicación y el ángulo de la vagina en pacientes con extrofia femenina. En un estudio, se informó sobre relaciones sexuales exitosas y en una minoría se notificó dispareunia. Una gran serie también informó que las pacientes con extrofia femenina mayores de 18 años tenían deseos sexuales normales y muchas eran sexualmente activas con orgasmos normales. Algunos pacientes estaban cohibidos y limitaban su actividad sexual debido a la apariencia estética de sus genitales externos. Una plastía del monte de venus es una parte importante de la reconstrucción en las mujeres y el uso de piel con pelos para cubrir el defecto de la línea media es una rutina.
Implicaciones obstétricas y ginecológicas
Muchas mujeres con extrofia vesical han dado a luz con éxito una descendencia normal (45 mujeres con 49 niños en un informe). Otro estudio mostró que 40 mujeres, de 19 a 36 años, fueron tratadas por extrofia vesical cuando eran bebés, y de esas 40 mujeres, se reportaron 14 embarazos en 11 mujeres. De esos 14 embarazos hubo 9 partos normales, 3 abortos espontáneos y 2 abortos electivos. El prolapso uterino ocurrió en 7 de los 11 pacientes durante el embarazo. Se considera que es muy común que estas mujeres tengan prolapso cervical y uterino después del embarazo y el parto. La cesárea se realiza en mujeres con cierre funcional de la vejiga para eliminar el estrés en el suelo pélvico y evitar lesiones traumáticas del mecanismo del esfínter urinario.
El prolapso de los órganos pélvicos parece ser un problema importante en pacientes con extrofia femenina. Suele observarse durante y después del embarazo o el parto, posiblemente en hasta la mitad de los pacientes. Puede ocurrir a edades tempranas y sin actividad sexual previa o en el embarazo. El desplazamiento anterior del orificio vaginal y el marcado desplazamiento posterior del cabestrillo dorsorectal y su compartimento anterior deficiente fueron teorizados como razones para el significativo porcentaje de mujeres que tendrán prolapso. Se considera que la reconstrucción más moderna del suelo pélvico y la re ubicación anatómica de la vejiga en la pelvis y el uso de osteotomías pueden mejorar este problema. Informes previos han mostrado que la suspensión uterina solo tuvo un éxito modesto en la prevención del prolapso recurrente. Sin embargo, Stein informó que la fijación uterina por sacrocolpopexia corrigió el prolapso en 13 mujeres con más de 25 años de seguimiento.
Extrofia cloacal
La extrofia cloacal es el defecto más grave que puede ocurrir en la formación de la pared abdominal ventral y representa la anomalía más grave del espectro de extrofia que es compatible con la vida. Esta entidad es extremadamente rara, y ocurre en 1 de cada 200,000-400,000 nacidos vivos. La relación entre hombres y mujeres ha sido reportada más recientemente en un gran estudio como igual entre los sexos, con una relación 1: 1. La mayoría de los casos son esporádicos. Sin embargo, se ha informado que la incidencia aislada de translocaciones desequilibradas pueden ser causantes de esta malformación. Aunque es probable que sea multifactorial, los estudios genéticos continúan ayudando a determinar posibles etiologías.
En el pasado, los niños con extrofia cloacal no sobrevivían más allá del período neonatal. En 1960, Rickham informó sobre el primer paciente con extrofia cloacal que sobrevivió a la reconstrucción quirúrgica. Con los avances en cuidados intensivos y las reparaciones anatómicas actuales, la mayoría de los pacientes actualmente pueden vivir bien hasta la edad adulta. El enfoque de la atención y la investigación ahora está en mejorar la calidad de vida de estos pacientes.
Anomalías anatómicas
La extrofia cloacal incluye hallazgos de extrofia del complejo intestino / vejiga, separación fálica completa, diastasis púbica amplia, íleon terminal prolapsado, ano imperforado y onfalocele. La extrofia cloacal se considera parte del complejo OEIS cuando se la ve coexistiendo con onfalocele, ano imperforado y defectos espinales.
El tracto urinario inferior está compuesto típicamente de dos hemivejigas extrofiadas adyacentes al segmento intestinal extrofriado en la línea media. Cada vejiga se drena por su uréter ipsilateral y se acerca mucho al hemifalo en el lado ipsilateral. Las variaciones, sin embargo, son frecuentes.
Anomalías neuro espinales
Se han observado anomalías neurospinales en el 85-100% de los pacientes con extrofia cloacal. Con una distribución de defectos lumbares (80%), torácicos (10%) y sacros (10%). Una sola revisión de un centro con 34 pacientes encontró 17 lipomeningoceles, 8 mielomeningoceles, 7 con espina bífida y 2 con médula anclada aislada. También se informa que solo 1 de cada 5 niños con disrafismo espinal por ultrasonido tiene un defecto evidente en el examen físico. Dado que existe un defecto neuro espinal casi constante, se recomienda que todos los pacientes con extrofia cloacal se sometan a una evaluación espinal mediante ecografía o resonancia magnética. Se informa que los hallazgos de la ecografía espinal son comparables a los de la RM para el diagnóstico de anomalías espinales en recién nacidos con extrofia cloacal. El ultrasonido es más rápido, más fácil y menos costoso de realizar y no requiere sedación. Por lo tanto, todos los niños con extrofia cloacal deben realizarse una ecografía espinal.
Los déficits sensoriales en el paciente con extrofia cloacal pueden variar ampliamente, desde la sensación casi normal de la pelvis y la extremidad inferior hasta las discapacidades graves que hacen que el paciente esté en silla de ruedas. La presencia de un déficit neurológico significativo se asocia negativamente.
Schlegel y Gearhart describieron por primera vez la neuroanatomía de la pelvis en el niño nacido con extrofia cloacal. La inervación autonómica de las mitades de la vejiga y los cuerpos corporales surge de un plexo pélvico en la superficie anterior del sacro. El falo generalmente se separa en la mitad derecha e izquierda con escroto o labios adyacentes. Ocasionalmente, el pene está unido en la línea media, pero la estructura es diminuta y los cuerpos cavernosos son pequeños.
Los nervios de las hemi vejigas viajan a lo largo de la línea media en la superficie posteroinferior de la pelvis y se extienden lateralmente. La inervación autonómica de las mitades fálicas surge del plexo pélvico sacro, viaja en la línea media, perfora la porción inferior del suelo de la pelvis y discurre medialmente hasta la hemi vejiga. Esta ubicación más medial de la inervación autónoma de la vejiga hace que sea fácil de lesionar en el momento de la disección y reconstrucción iniciales de la vejiga, lo que crea una vejiga neuropática iatrogénica.
McLaughlin y sus colaboradores postularon que la base embriológica de los defectos neuro espinales en la extrofia cloacal era secundaria a problemas derivados de la ruptura del tejido del mesénquima dorsal y no al fracaso del cierre del tubo neural.
Anomalías esqueléticas
Los defectos pélvicos en la extrofia cloacal son similares en naturaleza, pero más graves que los de la extrofia vesical. Sponceller y sus asociados describieron la anatomía pélvica mediante tomografías computarizadas en pacientes con extrofia cloacal. Se encontró que la diastasis interpúbica tenía una media de 0,5 cm en los controles y 8 cm en los pacientes con extrofia cloacal, que es casi el doble que en los pacientes con extrofia vesical. La longitud del segmento anterior (distancia desde el cartílago triradiado al pubis) fue un 37% más corta en pacientes con extrofia cloacal. Además, el ángulo del ala ilíaca se incrementó notablemente a 45 grados, mostrando la rotación externa extrema. Asimismo, el ángulo isquiopúbico se incrementó claramente en los niños con extrofia cloacal. En general, los pacientes con extrofia cloacal tienen anormalidades extremas de la pelvis: asimetría entre los lados, malformaciones de la articulación sacroilíaca y ocasionalmente malformaciones de la cadera.
Se notificaron anomalías esqueléticas y de las extremidades en 12-65% de los casos de extrofia cloacal. La mayoría eran deformidades de extremidades tipo pie zambo, pero en este grupo de pacientes también se observaron con frecuencia ausencia de pies, deformidades tibiales o de peroné severas y dislocaciones congénitas de cadera. Esto fue confirmado por Greene, quien reporta una alta incidencia de anomalías en los pies y en la abducción de la cadera.
Anomalías gastrointestinales
El onfalocele está presente en más del 88-100% de los pacientes con extrofia cloacal. Estos pueden variar ampliamente en tamaño y generalmente contienen intestino delgado, hígado o ambos. Se recomienda el cierre inmediato del defecto del onfalocele para prevenir la ruptura y evisceración. Se han notificado otras anomalías gastrointestinales significativas en cerca del 46% de los pacientes con extrofia cloacal. Dichas anomalías incluyen; malrotación intestinal, duplicación intestinal, atresia duodenal, diafragma duodenal y divertículo de Meckel. Por otra parte, se estima que el 25% de los pacientes con extrofia cloacal presentarán síndrome de intestino corto, el que también se puede encontrar en presencia de una longitud normal del intestino delgado, lo que sugiere una disfunción en la absorción. Esto refuerza la importancia de preservar la mayor cantidad de intestino posible y utilizar el remanente de intestino posterior en la reconstrucción intestinal y no utilizarlo para la reconstrucción urogenital.
Anomalías del tracto urinario superior
Varias series han demostrado la presencia de anomalías del tracto superior (41-60%). Las anomalías más comunes encontradas son; riñones pélvicos y agenesia renal, hidronefrosis e hidrouréter, que se presentan en hasta un tercio de los pacientes. Otras alteraciones incluyen la displasia renal multiquística, anomalías de fusión, duplicación ureteral, estenosis uretral congénita y megauréter. Se ha constatado que los uréteres ectópicos podían drenar en el conducto deferente en varones y en el útero, la vagina o las trompas de Falopio en mujeres.
Anomalías mullerianas y testiculares
La anomalías mullerianas son muy frecuentes en las pacientes con extrofia cloacal. La anomalía mulleriana más común reportada es la duplicación uterina (95%) , la mayoría con duplicación parcial o útero bicorne. También se ha informado duplicación de la vagina (65%) y agenesia vaginal (25-50%). Gearhart y Jeffs recomiendan preservar inicialmente todas las anomalías de duplicación mullerianas para su posible utilización en la reconstrucción del tracto urinario inferior.
En dos series de revisiones de Hurwitz y col., así como de Ricketts y col., encontraron alta incidencia de testículos no descendidos, los que se ubicaron a nivel inguinal o abdominal y se asociaron comúnmente con hernias inguinales.
Anomalías cardiovasculares y pulmonares
Malformaciones pulmonares y/o cardíacas que amenacen con la vida son infrecuentes. Sin embargo, existen informes de casos de pacientes con cardiopatía cianótica, duplicación aórtica, duplicación de la vena cava, pulmón bilobulado y un bronquio atrético del lóbulo superior.
Diagnóstico prenatal
Austin y sus colegas establecieron criterios mayores y menores para el diagnóstico prenatal de extrofia cloacal según la incidencia de los hallazgos de la ecografía prenatal en 20 pacientes.
Los criterios principales se encontraron en> 50% de los casos e incluyeron:
- No visualización de la vejiga (91%)
- Defecto de la pared anterior infraumbilical de línea media grande o una estructura de la pared anterior quística (82%)
- Onfalocele (77%)
- Mielomeningocele (68%).
Los criterios menores incluyeron:
- Anomalías de las extremidades inferiores (23%)
- Anomalías renales (23%)
- Ascitis (41%)
- Arcos púbicos ensanchados (18%)
- Tórax estrecho en (9%),
- Hdrocefalia (9%)
- Arteria umbilical única (9%).
También se ha sugerido agregar el aspecto característico del tronco de elefante que puede producir el íleon terminal prolapsado. Independientemente de los criterios, la entidad es muy rara y aún difícil de diagnosticar antes del nacimiento. Cuando se realiza un diagnóstico prenatal, los padres deben ser asesorados por un cirujano genitourinario experto en extrofia y referidos a un centro de excelencia de extrofia para el parto.
Evaluación neonatal
El cuidado de estos pacientes complejos debe realizarse en un centro de excelencia de extrofia que tenga experiencia y disponibilidad de recursos para estos pacientes. Las placas de intestino / vejiga deben mantenerse húmedas y protegidas con solución salina tibia y una envoltura de plástico transparente, del mismo modo que la extrofia vesical. La condición del bebé al nacer puede ser crítica y los intentos de reconstrucción y reparación pueden ser inapropiados y / o éticamente no recomendados. A menudo, la gravedad de la extrofia cloacal se ve aumentada por la naturaleza y la gravedad de las anomalías asociadas. El manejo inmediato está destinado a estabilizar médicamente al recién nacido. La evaluación debe involucrar a un equipo multidisciplinario, como se discutió anteriormente, para la extrofia vesical. Una evaluación exhaustiva de todas las anomalías es fundamental para la planificación de la reconstrucción a corto y largo plazo. Esto debe incluir una discusión sobre la asignación de género y debe incluir un equipo experto en desordenes de diferenciación sexual (DSD). Idealmente, este equipo incluiría un urólogo pediátrico, un cirujano pediátrico, un neonatólogo, un endocrinólogo pediátrico y un psicólogo / psiquiatra infantil. Las decisiones solo deben tomarse después del asesoramiento, educación y consejería a los padres.
Asignación de género
En el pasado, la reasignación de género de hombre a mujer en pacientes con extrofia cloacal masculina era algo común. En la actualidad, es un consenso general entre los expertos que es importante asignar el género que sea compatible con el cariotipo en esta població. Esto es apoyado por el trabajo de Mathews y asociados que muestran que la histología de los testículos extirpados en el momento de la reasignación de género era normal.
La necesidad de reasignación de género podría represntar un problema en aquellos pacientes con extrofia cloacal masculina 46XY con estructuras fálicas inadecuadas para la reconstrucción. Como las técnicas quirúrgicas para la reconstrucción fálica han evolucionado, casi siempre se puede construir un falo funcional y estéticamente aceptable. Esto es cierto incluso si solo están presentes estructuras fálicas unilaterales o parciales. Obviamente, este es un procedimiento complejo que debe realizarse en un centro especializado para obtener los mejores resultados, quirúrgica y psicosocialmente.
Reconstrucción quirúrgica inmediata
Los procedimientos de reconstrucción del paciente con extrofia cloacal deben ser individualizados y planificarse cuidadosamente. Entre las decisiones importantes que se deben tomar durante la planificación operatoria inicial está si se realizará el cierre en una o dos etapas. Si es posible, se prefiere en una etapa, para minimizar el número de procedimientos neonatales y permitir que la vejiga se proteja e interiorice, reduciendo así el riesgo de traumas externos, la formación de pólipos y mejorando, potencialmente, las posibilidades de un desarrollo normal. Durante el procedimiento, se extirpa el onfalocele y se separa el intestino de las hemivegijas. Se debe tener cuidado cuando el intestino se separa de las mitades de la vejiga para evitar daños en la vasculatura del mesenterio intestinal y la inervación vesical autónoma, la cual queda expuesta en la cara medial de cada hemi vejiga. La fisura vesicointestinal lateral se cierra y se crea una colostomía corta en el extremo distal del colon. Las hemi vejigas se vuelven a aproximar en la línea media para crear una vejiga extrófica única. Si se selecciona una etapa, la vejiga se cierra completamente como en un paciente con extrofia vesical clásica. Las osteotomías bilaterales se realizan si el procedimiento se realiza después de las primeras 72 horas de vida. Cuando existe un gran onfalocele, el cierre de la vejiga y la osteotomía pueden retrasarse hasta que se logre la estabilidad respiratoria y gastrointestinal.
En pacientes con disrafismo espinal y mielomeningocele, debe completarse una evaluación neuro quirúrgica y cerrarse tan pronto como el bebé esté médicamente estable. El seguimiento a largo plazo es importante ya que hasta el 33% de los niños pueden tener anclajes medulares sintomáticos.
Manejo del intestino
Antiguamente, los pacientes morían por pérdida de líquidos y electrolitos secundarios a un intestino corto y una ileostomía terminal. Ahora se acepta que la mejor y la primera prioridad al manejar el segmento de intestino posterior es la preservación cuidadosa y la incorporación del colon en el tracto gastrointestinal para optimizar la longitud del intestino. Se puede usar inicialmente como una colostomía fecal, y puede ayudar a la absorción y prevenir la pérdida de líquido. También cuando el intestino grueso se agranda, si se usa para una colostomía fecal, más tarde podría usarse como un segmento para realizar una ampliación vesical y/o un reemplazo vaginal. En cualquier caso, el énfasis principal debe estar en salvar la mayor cantidad de intestinos posible.
La colocación de la colostomía o ileostomía en una ubicación favorable es muy importante. Debe estar donde se pueda manejar fácilmente con bolsa. En una etapa más tarde, a medida que el niño crece y en aquellos casos en que existe un intestino posterior adecuado y no hay déficits neurológicos, se podría ofrecer realizar un procedimiento de descenso mediante el abordaje sagital posterior. Hay que enfatizar que, para maximizar la calidad de vida en estos pacientes, se debe adoptar un programa agresivo de manejo intestinal. No todos los pacientes serán buenos candidatos para un procedimiento de descenso. También se debe hacer un esfuerzo para mantener cualquier estructura apendicular para la construcción posterior de un estoma continente si fuera necesario.
Manejo del falo y la vagina
En los hombres con extrofia cloacal, el pene suele estar representado por dos estructuras fálicas pequeñas y separadas. Debido a que estas estructuras son rudimentarias y están muy separadas, la reconstrucción es un desafío. Sin embargo, cuando hay tejido corporal adecuado, la reparación de las epispadias se puede realizar al mismo tiempo del cierre inicial, o más tarde, según el paciente.
La corrección de anomalías genitales en las niñas generalmente se realiza en el momento del cierre de la vejiga y la osteotomía. El aspecto medial del hemiclitoris carece de mucosa y las mitades se pueden unir. Comúnmente, las vaginas duplicadas están muy separadas y en lados opuestos de la pelvis. En el caso inusual de que las vaginas estén juntas, deben unirse en la línea media y usarse para una reconstrucción posterior. La salida de las vaginas puede ser difícil de encontrar en el momento del cierre inicial, y el cirujano debe ser consciente de que podrían entrar en las paredes posteriores de la vejiga. Es aceptable dejar las vaginas in situ, pero se necesitará cirugía más tarde para llevar una de estas al perineo.
Reconstrucción del tracto urinario inferior
En la reparación primaria completa de una etapa que se aplica a la extrofia cloacal, el intestino posterior se corta y se incorpora a la colostomía como se describió anteriormente. Las dos hemi vejigas se vuelven a aproximar en la línea media y el onfalocele se repara y se cierra para dar la apariencia de un paciente con extrofia vesical clásica. La reparación primaria completa se puede intentar en los casos en que el paciente esté hemodinámicamente estable, el onfalocele sea pequeño, la diastasis del pubis no sea amplia y la función pulmonar sea adecuada para tolerar un aumento de la presión intraabdominal. Si no se cumplen estos criterios, la placa de la vejiga del paciente debe cubrirse y mantenerse nuevamente con una envoltura de plástico con irrigación frecuente con solución salina hasta el momento del cierre vesical definitivo.
Si se considera que el paciente es un candidato adecuado, se pueden iniciar los siguientes pasos en la reparación primaria completa. El desmontaje completo del pene y la división de la banda intersinfisaria son pasos cruciales para permitir la colocación posterior de la vejiga y la uretra. Luego, la reconstrucción de la vejiga, el pene, el abdomen y la pelvis se aproxima a la anatomía normal. Las osteotomías casi siempre son necesarias para ayudar al cierre y la colocación posterior del tracto urinario inferior. El drenaje postoperatorio y la inmovilización son importantes a través de stents ureterales, un tubo suprapúbico y posiblemente un catéter uretral junto con una tracción y/o fijación externa similar a los usados para la extrofia vesical clásica.
Si se realiza un cierre de una etapa, los huesos púbicos y la pelvis se pueden volver a aproximar de la misma manera que en la reparación primaria completa de la extrofia vesical clásica. Independientemente, el objetivo es lograr una aproximación libre de tensión de los huesos púbicos ampliamente separados y de la pared abdominal anterior. La osteotomía anterior también proporciona una superficie esponjosa amplia, con un buen potencial de curación. Además, en casos de diástasis púbica extrema, se puede realizar una osteotomía innominada anterior y posterior combinada dentro del periostio a través de la misma incisión en la piel para una mejor corrección. Ben-Chaim y sus colegas han demostrado la importancia de la osteotomía en el momento del cierre de la extrofia cloacal. Silver y sus asociados han aplicado un enfoque novedoso para la osteotomía en pacientes con extrofia cloacal con cierres anteriores fallidos o diástasis extrema. En este enfoque, la osteotomía se realiza junto con la colocación de un fijador externo seguido por el cierre del anillo pélvico y los tejidos blandos dos o tres semanas después de que la pelvis se haya reducido gradualmente por aproximación del fijador.
Manejo de la incontinencia urinaria
En estos paciente, es probable que se necesite un cateterismo limpio intermitente para el vaciado después de cualquier procedimiento para mejorar la resistencia al tracto de salida. Esto puede deberse en parte a defectos espinales, que pueden causar un déficit neurológico en la función de la vejiga, o a la capacidad vesical marcadamente reducida, que frecuentemente requiere una cirugía de aumento. En ambos casos, la actividad del detrusor de la vejiga se ve afectada. En casos cerrados con reparación primaria completa, la presencia de un tabique vesical puede impedir una función vesical adecuada y se cree que está relacionado con los restos de intestino posterior que se incorporan en el cierre, cuando se identifica, se puede requerir un procedimiento alternativo para separar este tabique. El papel de la reparación del cuello vesical en la extrofia cloacal es mínimo. Husmann y colaboradores mostraron claramente una diferencia muy marcada en los resultados de continencia entre la extrofia cloacal y la extrofia vesical clásica. Esto se debe probablemente a las anormalidades neurológicas coexistentes. La cirugía para producir un reservorio continente debe posponerse hasta que el niño tenga la edad suficiente para involucrarse en su cuidado (autocateterismo). La elección entre una uretra cateterizable o un estoma depende de la uretra, del cuello vesical, de las capacidades intelectuales y la destreza del niño y el estado ortopédico del paciente en lo que respecta a la columna vertebral, las articulaciones de la cadera y la deambulación.
Ocasionalmente, el intestino posterior está disponible para ampliar la vejiga, pero tradicionalmente se ha usado el íleon. En un esfuerzo por evitar una mayor pérdida de la superficie de absorción, Adams y sus colegas han utilizado el estómago para una gastrocistoplastia con éxito, aunque existen problemas de cáncer a largo plazo. Independientemente de qué segmento intestinal se elija, la ampliación vesical debe retrasarse hasta que la función intestinal esté madura y la nutrición y la acidosis ya no sean un problema.
Algunos pacientes con lesiones neurológicas mínimas tienen una vejiga funcional y pueden vaciar a través de una uretra reconstruida. Sin embargo, pueden ser necesarios métodos no tradicionales para construir un tracto de salida en pacientes sin tejidos uretrales nativos. Estas técnicas incluyen el uso de la vagina para formar una uretra, con la reimplantación de la vagina en la vejiga para la continencia, o un mecanismo de válvula tipo "pezón ileal", según lo descrito por Hendren. La continencia urinaria es posible en la mayoría de los niños, pero generalmente requerirá un aumento vesical y un cateterismo intermitente.
Cuestiones psicológicas y psicosexuales a largo plazo
Con la mejora de la supervivencia y la cirugía reconstructiva, los problemas del desarrollo a largo plazo se han convertido en algo primordial. Reiner ha informado sobre seis niños que se han sometido a una reasignación de género, todos con dificultades de desarrollo. Dos tuvieron reasignación a género masculino. En contraste, Shober informó 46 pacientes con extrofia cloacal XY a quienes todos tenían una identidad de género central femenina típica en el seguimiento a largo plazo. Los pacientes tienen que ser seguidos a la vida adulta para tomar decisiones apropiadas y obtener información de la calidad de vida a largo plazo.
Resumen
El manejo de la extrofia cloacal ha mejorado para brindar una mejor calidad de vida a estos niños. La reconstrucción completa en el período del recién nacido parece ser el mejor enfoque si la condición del bebé lo permite. El manejo neurológico y gastrointestinal tiene prioridad sobre la reparación urológica y genital y el intestino posterior debe incorporarse para maximizar la longitud y la función del intestino. Las mejoras en la evaluación neurológica han servido para reducir las complicaciones que amenazan la vida y la progresión de los déficits neurológicos. La continencia urinaria es posible en la mayoría de los niños, pero siempre requiere una reconstrucción adicional. Las técnicas de reconstrucción quirúrgica actuales han avanzado lo suficiente como para los pacientes con XY puedan ser reconstruidos y criados como hombres, lo que parece ser la opción óptima; sin embargo, se necesitan más evaluaciones a largo plazo para evaluar la satisfacción de estos pacientes. Los avances en la ingeniería tisular y la investigación con células madre probablemente permitirán la crianza congruente de todos los pacientes masculinos con extrofia cloacal.
Figuras
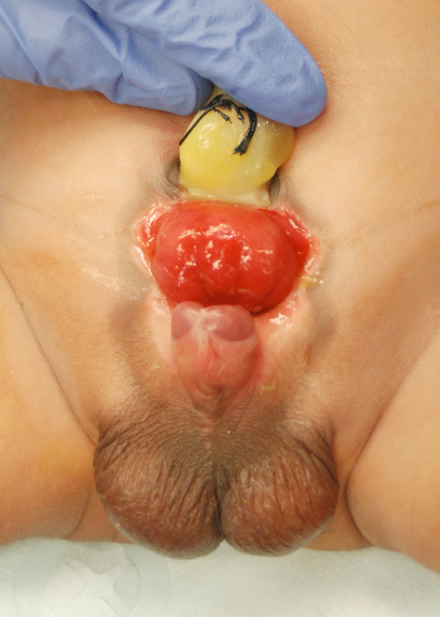
Figura 1: Recién nacido con extrofia vesical clásica.
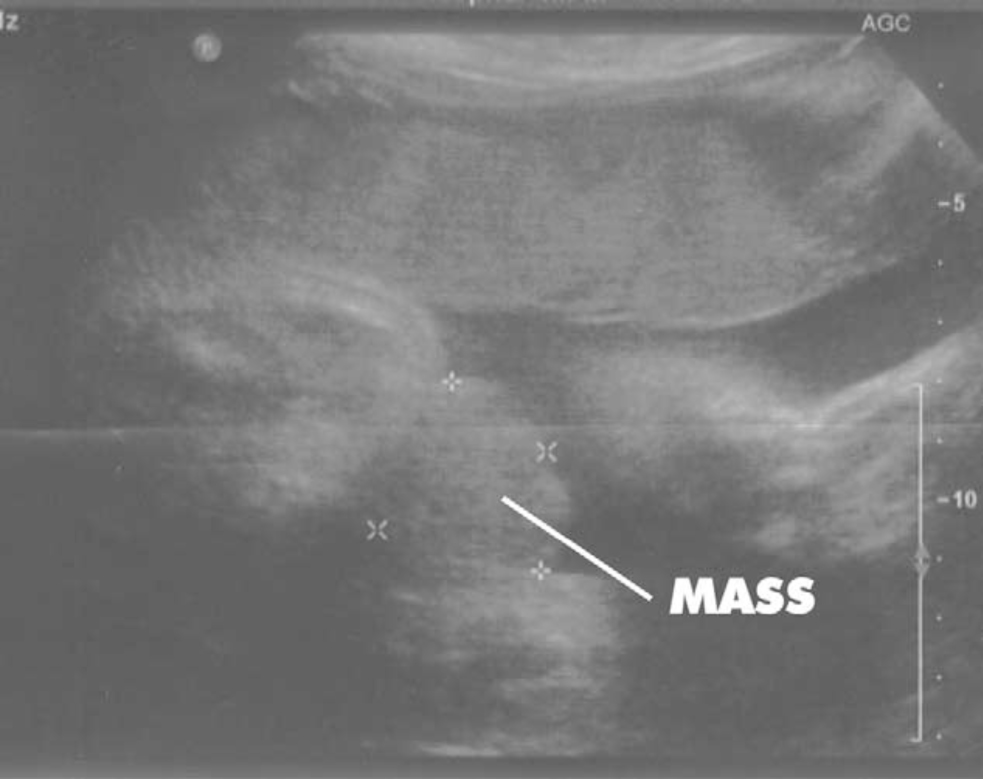
Figura 2: ultrasonido de gestación de 30 semanas que muestra ausencia de vejiga y una masa abdominal inferior.
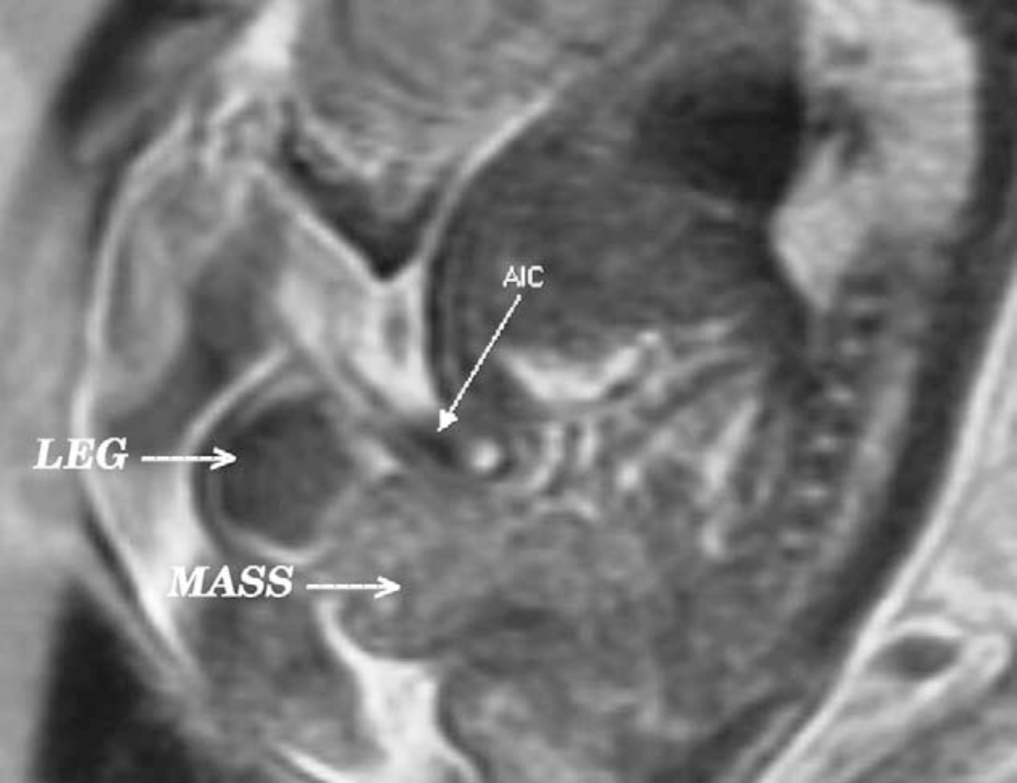
Figura 3: Vista sagital de la extrofia vesical (masa) debajo de la inserción abdominal del cordón umbilical (AIC) en la RM prenatal T2.
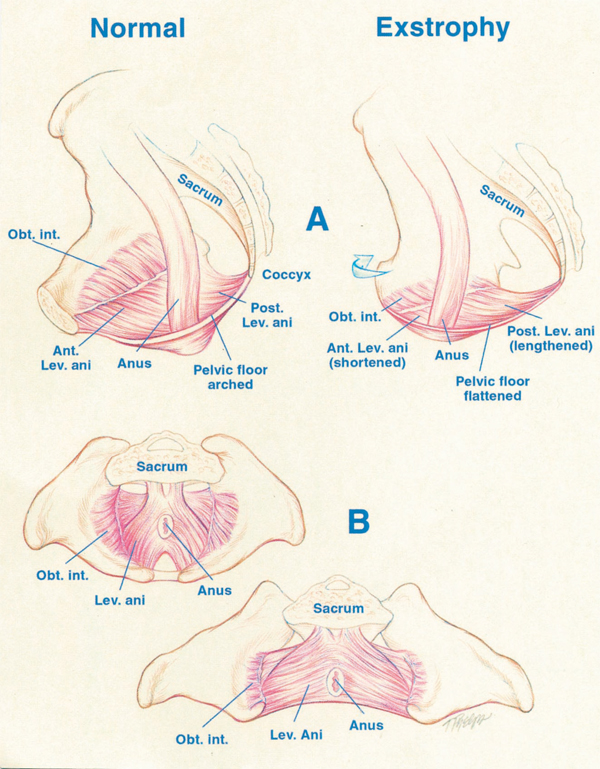
Figura 4: Desplazamiento del elevador del ano a una posición más posterior. En el paciente con extrofia.
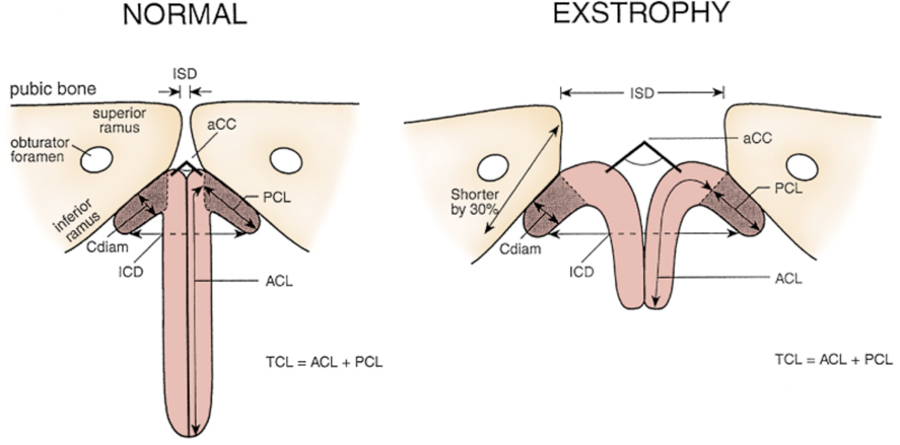
Figura 5: Mediciones del pene y la pelvis en hombres normales y pacientes con extrofia.
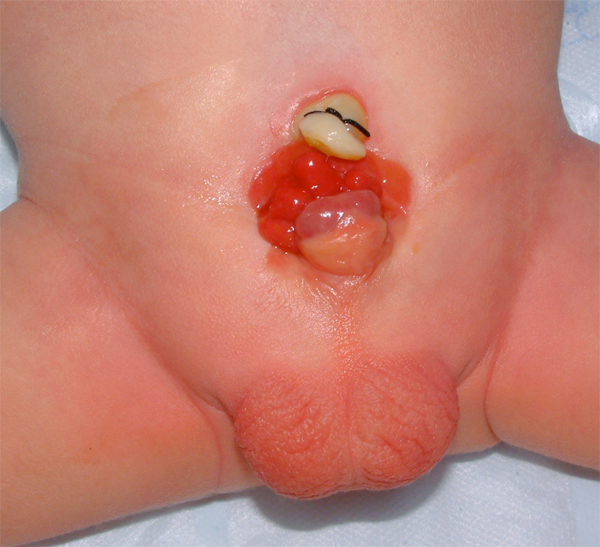
Figura 6: Recién nacido con extrofia vesical clásica. Tenga en cuenta múltiples pólipos en la placa vesical.
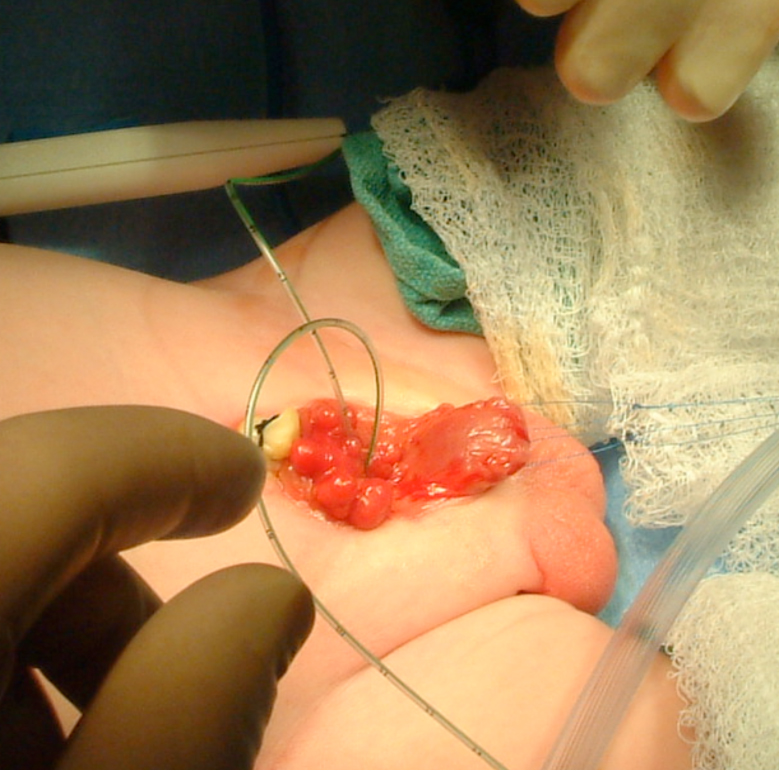
Figura 7: Intubación de orificios ureterales bilaterales en preparación para la disección.
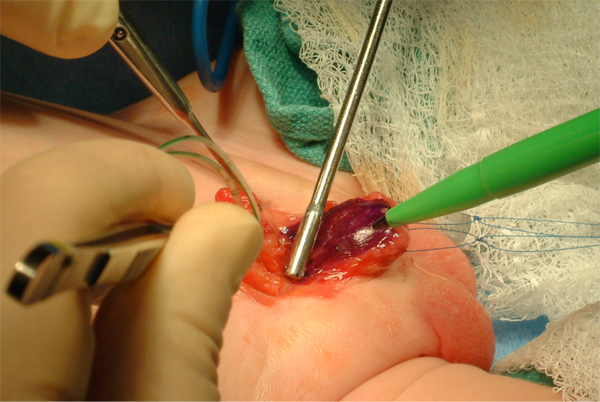
Figura 8: Marcaje de placa uretral. Observe dos suturas de tracción en cada hemi glande.
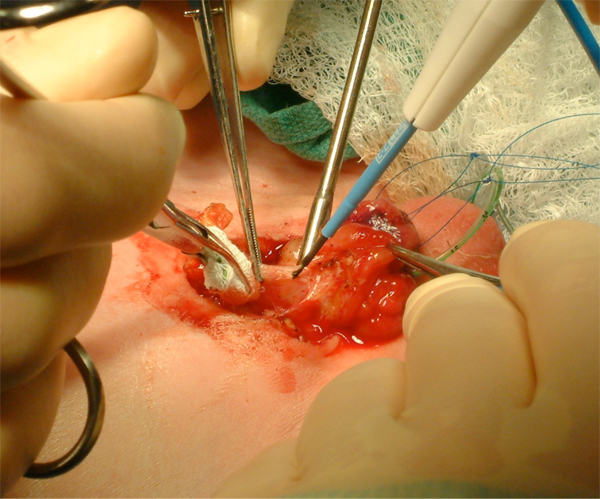
Figura 9: Movilización agresiva de la vejiga, incluido el ombligo.
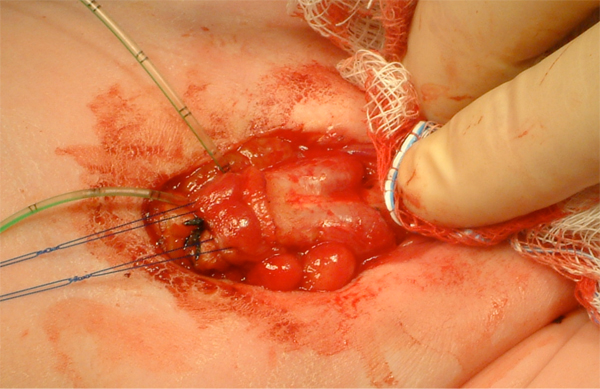
Figura 10: Identificación de cuerpos cavernosos bilaterales después del desprendimiento del falo.
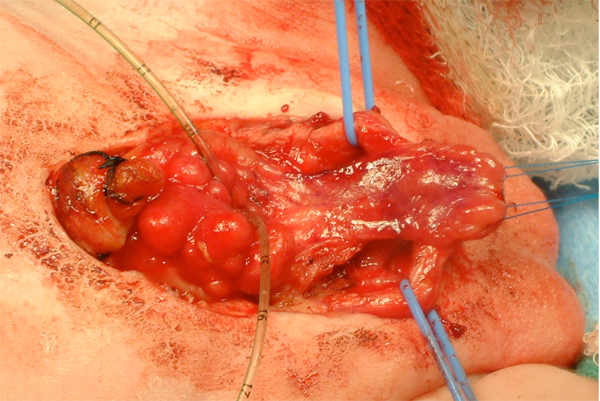
Figura 11:: Después de la separación de los cuerpos cavernosos y la movilización de la placa uretral.
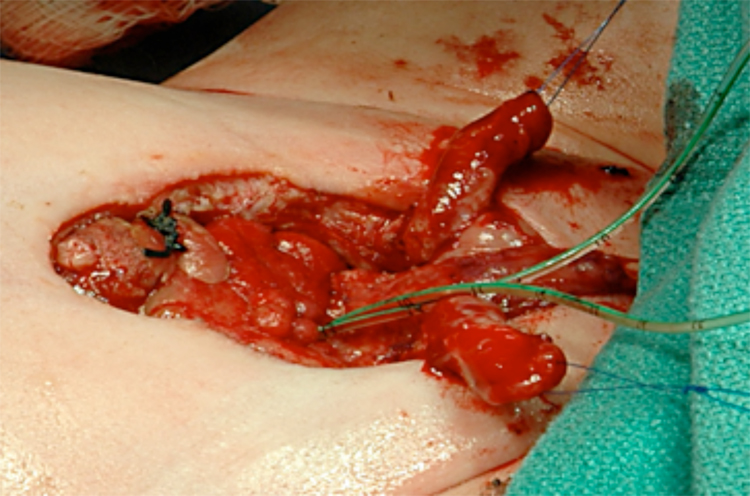
Figura 12:: Después de la separación completa de los cuerpos cavernosos y el glande.
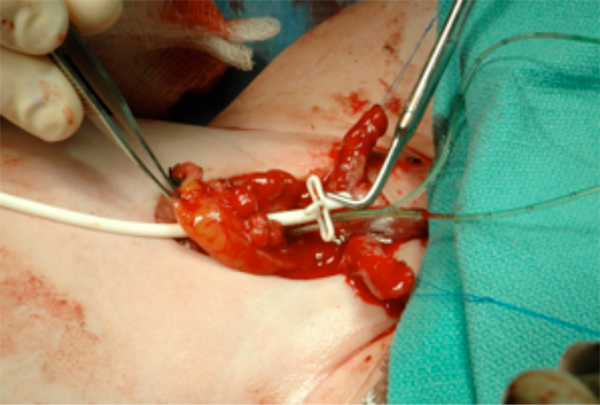
Figura 13:: Colocación del tubo suprapúbico antes del cierre de la vejiga. Esto saldrá del abdomen por el ombligo.
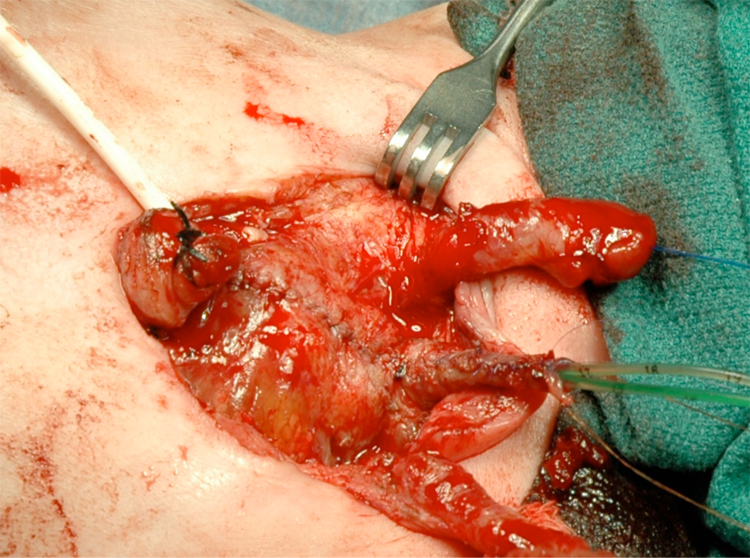
Figura 14:: vejiga y uretra cerradas en 2 capas como una sola unidad. Obsérvense los catéteres ureterales bilaterales que salen a través del meato uretral.
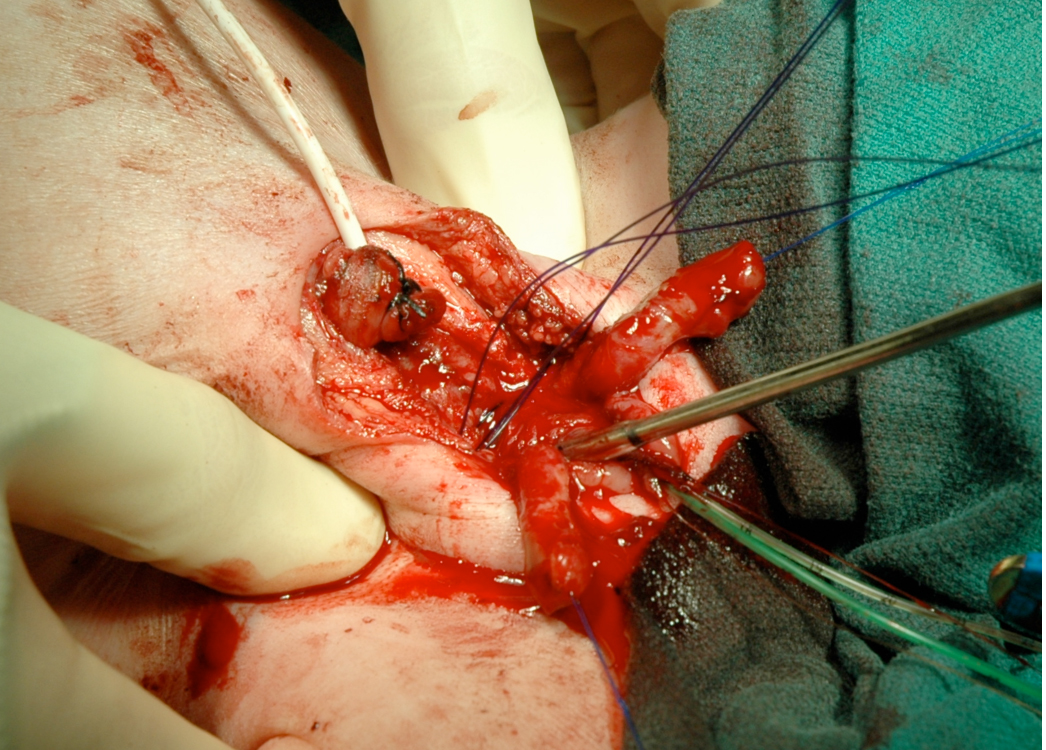
Figura 15:: Se puede lograr la rotación interna de la pelvis para volver a aproximarse al pubis cuando se reconstruye en las primeras 72 horas de vida.
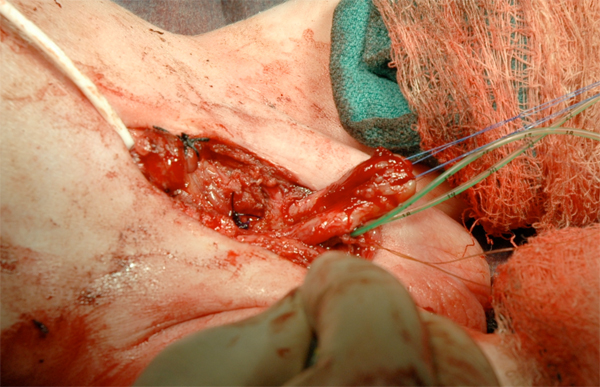
Figura 16:: Reconstrucción del falo.
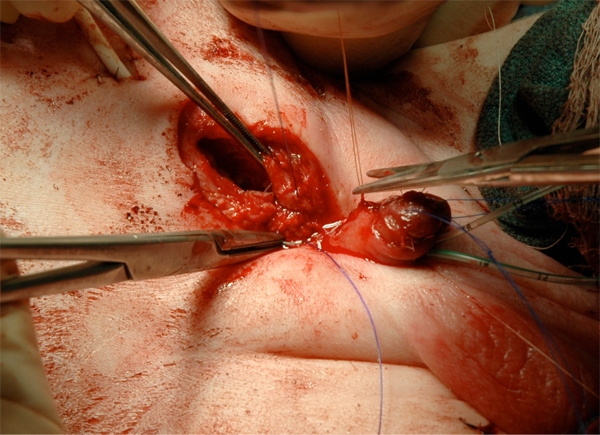
Figura 17:: Cierre fascial.
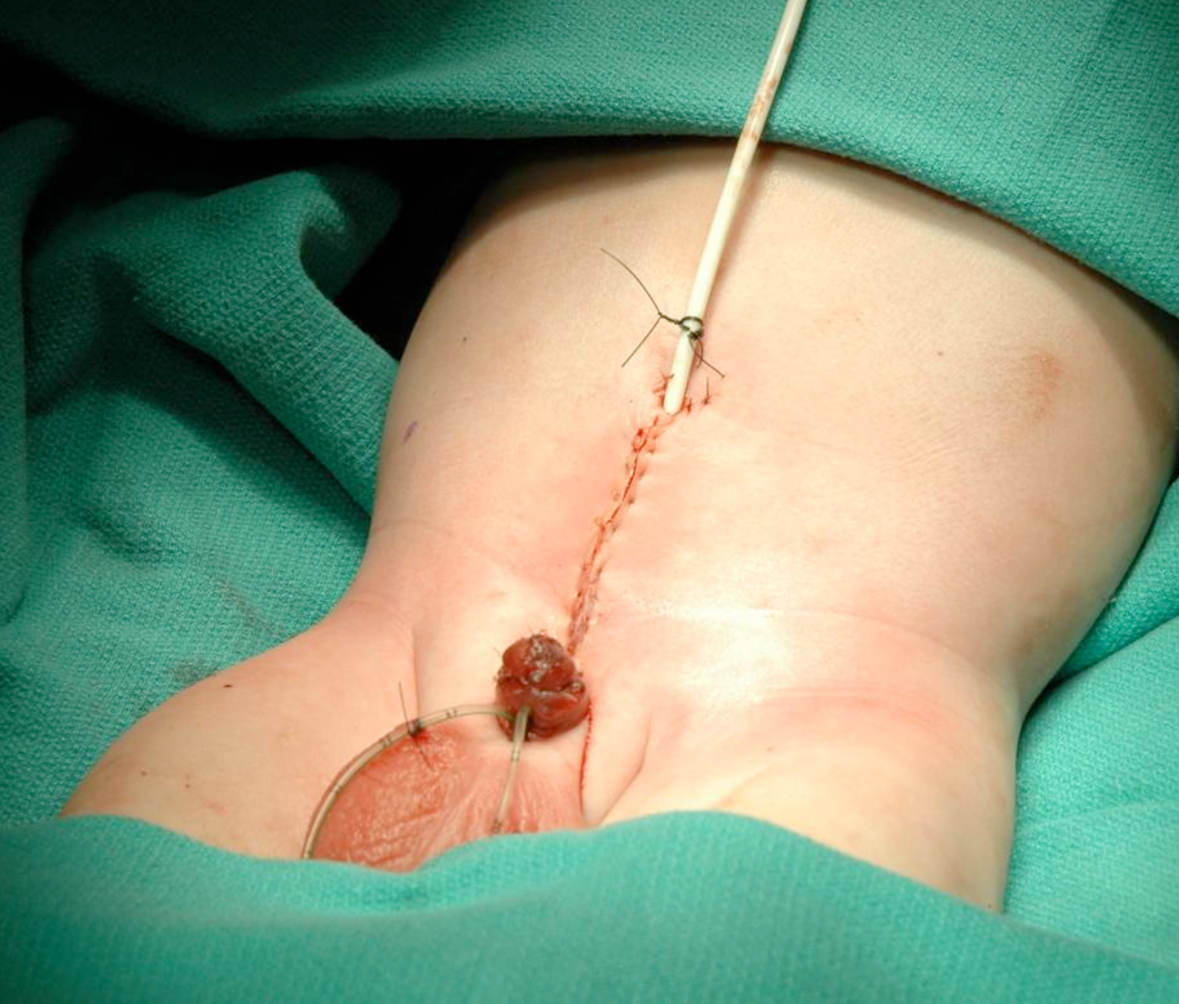
Figura 18:: Cierre de la pared abdominal.
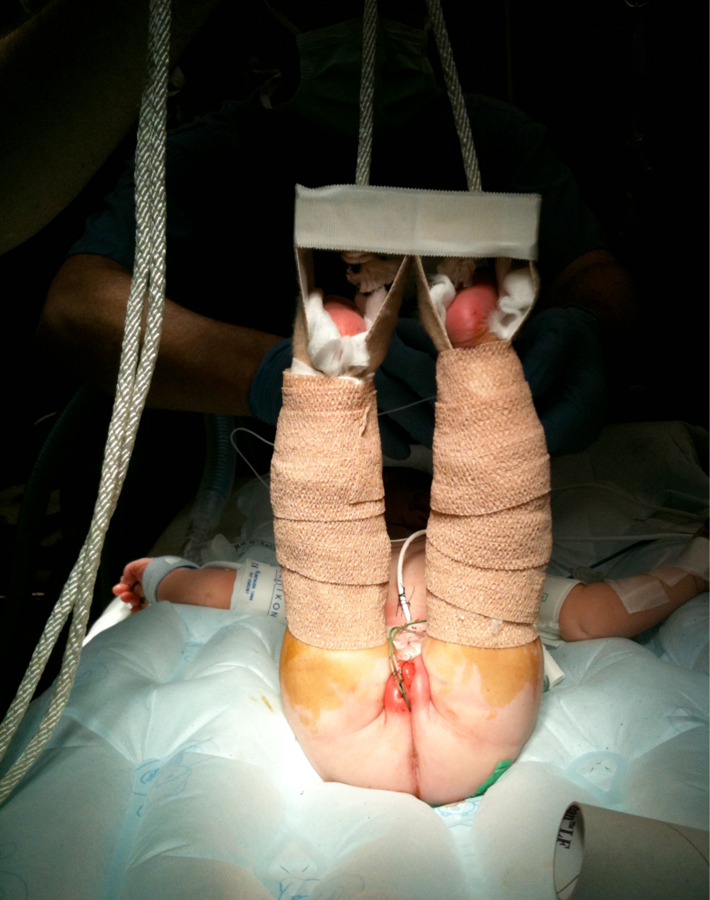
Figura 19:: Tracción modificada de Bryant.
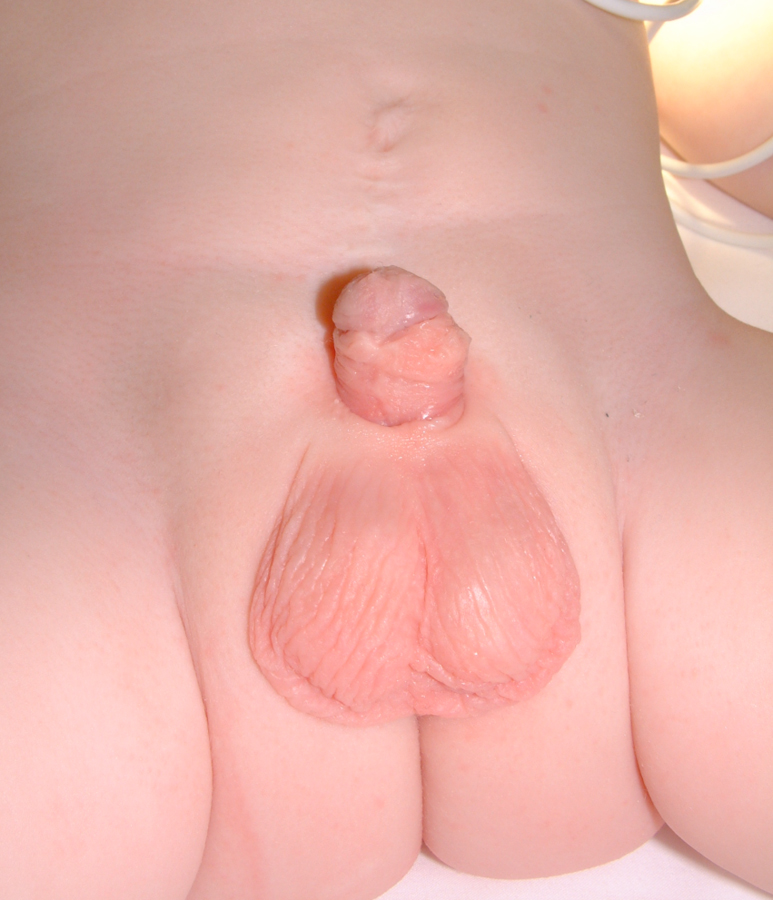
Figura 20:: Postoperatorio.
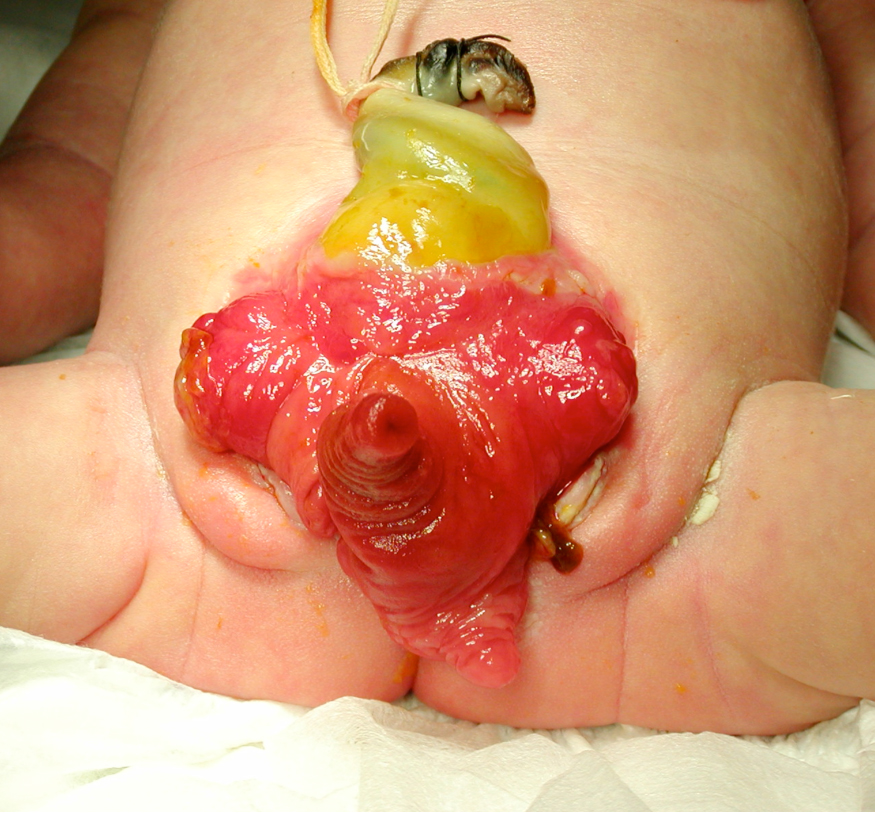
Figura 21:: Recién nacido con extrofia cloacal.
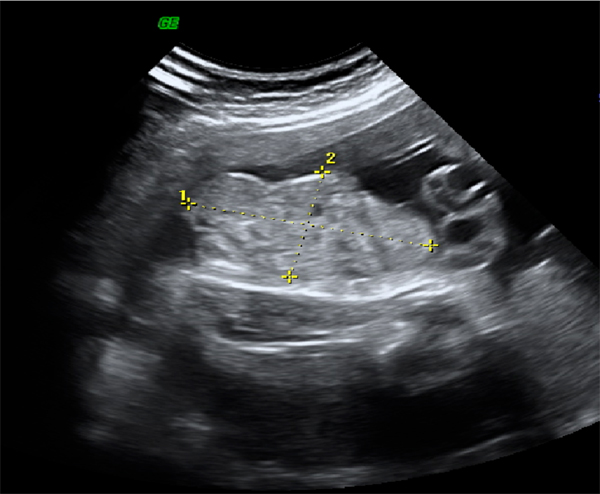
Figura 22:: Ecografía prenatal de mujer con extrofia cloacal. Obsérvese la masa compleja de la pared abdominal anterior inferior a la inserción del cordón umbilical. No se visualiza vejiga.
Referencias
Hsieh K, O'Loughlin MT, Ferrer FA. Bladder Exstrophy and Pheontypic Gender Determination on Fetal Magnetic Resonance Imaging. Urology 2005; 65: 998-999. Stec AA, Pannu HK, Tadros YE, et al: Pelvic floor evaluation in classic bladder exstrophy using 3-dimensional computerized tomography-Initial insights. J Urol 2001; 166: 1444. Silver RI, Partin AW, Epstein JI, et al: Prostate specific antigen in men born with bladder exstrophy. Urology 1997; 49: 253. Reiner WG. Psychosocial concerns in bladder and cloacal exstrophy. Dialogues in Pediatric Urology 1999; 22: 8. Shober JM, Carmichael PA, Hines M, et al. The ultimate challenge of cloacal exstrophy. J Urol 2002; 167: 300. Lee RS, Grady R, Joyner B, Casale P, et al. Can a complete primary repair approach be applied to cloacal exstrophy? J Urol 2006:176Z:2643. Ben-Chaim J, Sponseller PD, Jeffs RD, et al. Application of osteotomy in cloacal exstrophy patients. J Urol 1995; 154: 865. Silver RI, Sponseller PD, Gearhart JP. Staged closure of the pelvis in cloacal exstrophy: first description of a new approach. J Urol 1999; 161: 263. Adams MC, Mitchell ME, Rink RC. Gastrocystoplasty: an alternative solution to the problem of urological reconstruction in the severely compromised patient. J Urol 1988; 140: 1152. Hendren WH. Ileal nipple for continence in cloacal exstrophy. J Urol 1992; 148: 372. Tank ES, Lindenaur SM: Principles of management of exstrophy of the cloaca. Am J Surg 1970; 119: 95. Gearhart JP, Jeffs RD:. Techniques to create urinary continence in cloacal exstrophy patients. J Urol 1991; 146: 616. Ricketts R, Woodard JR, Zwiren GT, et al. Modern treatment of cloacal exstrophy. J Pediatr Surg 1991; 26: 444. Austin P, Holmsy YL, Gearhart JP, et al. Prenatal diagnosis of cloacal exstrophy. J Urol 1998; 160: 1179. Hamada H, Pakano K, Shinah H, et al. New ultrasonographic criterion for the prenatal diagnosis of cloacal exstrophy: elephant trunk-like image. J Urol 1999; 162: 2123. Husmann DA, McLorie GA, Churchill BM. Phallic reconstruction in cloacal exstrophy. J Urol 1989; 142: 563. Mathews RI, Perlman E, Gearhart JP: Gonadal morphology in cloacal exstrophy: implications in gender assignment. BJU Int 1999; 83: 484. Reiner WG. Psychosexual development in genetic males assigned female: the cloacal exstrophy experience. Child Adolesc Psychiatr Clin North Am 2004; 13: 657. Schober JM, Carmichael PA, Hines M, Ransley PG. The ultimate challenge of cloacal exstrophy. J Urol 2002; 167: 300. Baker Towell DM, Towell AD. A preliminary investigation into quality of life, psychological distress and social competence in children with cloacal exstrophy. J Urol 2003; 169: 1850. Taghizadeh A, Qteishat A, Cuckow PM. Restoring hindgut continuity in cloacal exstrophy: A valuable method of optimizing bowel length. Eur J Pediatr Surg 2009; 19: 141. Husmann DA, McLorie GA, Churchill BM: Closure of the exstrophic bladder: an evaluation of the factors leading to its success and its importance on urinary continence. J Urol 1989; 142: 522. Ricketts R, Woodard JR, Zwiren GT, et al. Modern treatment of cloacal exstrophy. J Pediatr Surg 1991; 26: 444. Levitt MA, Mak GZ, Falcone RA Jr., Pena A. Cloacal exstrophy – pull-through or permanent stoma? A review of 53 patients. J Ped Surg 2008; 43: 164. Hurwitz RS, Manzoni GA, Ransley PG, et al. Cloacal exstrophy: a report of 34 cases. J Urol 1987; 138: 1060. Thauvin-Robinet C, Faivre L, Cusin V, et al. Cloacal exstrophy in an infant with 9q34.1-qter deletion resulting from a de novo unbalanced translocation between chromosome 9q and Yq. Am J Med Genet A 2004; 126: 303. Rickham PP. Vesicointestinal fissure. Arch Dis Child 1960; 35: 97. Mathews R, Jeffs RD, Reiner WG, et al. Cloacal exstrophy-improving the quality of life: The Johns Hopkins experience. J Urol 1998; 160: 2452. Keppler-Noreiul KM. OEIS complex (omphalocele-exstrophy-imperforate anus-spinal defects): a review of 14 cases. Am J Med Genet 2001; 99: 271. Appignani BA, Jaramillo D, Barnes PD, et al. Dysraphic myelodysplasias associated with urogenital and anorectal anomalies: prevalence and types seen with MR imaging. AJR Am J Roentgenol 1994; 163: 1199. McLaughlin KT, Rink RC, Kalsbeck GE, et al. Cloacal exstrophy: the neurological implications. J Urol 1995; 154: 782. Karrer FM, Flannery AM, Nelson MDJ, et al. Anorectal malformations: evaluation of associated spinal dysraphic syndromes. J Pediatr Surg 1988; 23: 45. Dick EA, de Bruyn R, Patel K, et al. Spinal ultrasound in cloacal exstrophy. Clin Radiol 2001; 56: 289. Husmann DA, Vandersteen VR, McLorie GA, et al. Urinary continence after staged bladder reconstruction in cloacal exstrophy: the affect of co-existing neurological abnormalities on urinary continence. J Urol 1999;161;1598. Schlegel PN, Gearhart JP. Neuroanatomy of the pelvis in an infant with cloacal exstrophy: a detailed microdissection with histology. J Urol 1989; 141: 583. Cohen AR. The mermaid malformation: cloacal exstrophy and occult spinal dysraphism. Neurosurgery 1991; 28: 834. Sponseller PD, Bisson LJ, Gearhart JP, et al. The anatomy of the pelvis in the exstrophy complex. J Bone Joint Surg Am 1995; 77: 177. Stec AA, Wakim A, Barbet P, et al. Fetal bony pelvis in the bladder exstrophy complex: Normal potential for growth? Urology 2003; 62: 337. Diamond DA: Management of cloacal exstrophy. Dial Pediatr Urol 1990; 13: 2. Greene WB, Dias LS, Lindseth RE, et al. Musculoskeletal problems in association with cloacal exstrophy. J Bone Joint Surg Am 1991; 73: 551. Hurwitz RS, Manzoni GA, Ransley PG, et al. Cloacal exstrophy: a report of 34 cases. J Urol 1987; 138: 1060. Baird AD, Nelson CP, Gearhart JP. Modern staged repair of bladder exstrophy: a contemporary series. J Pediatr Urol 2007; 3: 311. Purves JT, Baird AD, Gearhart JP. The modern staged repair of bladder exstrophy in the female: a contemporary series. J Pediatr Urol 2008; 4: 150. Hanna MK, Williams DI. Genital function in males with vesical exstrophy and epispadias. BJU Int 1969; 44: 1972. Stein R, Stuckel M, Fisch M, et al. Fate of the adult exstrophy patient. J Urol 1994; 152: 1413. Bastuba MD, Alper MM, Oats RD. Fertility and the use of assisted reproductive techniques in the adult male exstrophy patient. Fertil Steril 1993; 60: 733. Woodhouse CR. Sexual function in boys with exstrophy, myelomeningocele, and micropenis. Urology 1998; 52: 3. Ben-Chaim J, Jeffs RD, Reiner WG, et al. The outcome of patients with classic bladder exstrophy in adult life. J Urol 1996; 155: 1251. Kropp BP, Cheng EY. Total urogenital complex mobilization in female patients with exstrophy. J Urol 2000; 164: 1035. Woodhouse CR. The gynecology of exstrophy. BJU Int 1999; 83: 34. Mathews RI, Gan, M, Gearhart JP. Urogynaecologic and obstetric issues in women with the exstrophy-epispadias complex. BJU Int 2003; 91: 845. Kramer SA, Jackson IT. Bilateral rhomboid flaps for reconstruction of the external genitalia in epispadias-exstrophy. Plast Reconstr Surg 1986; 77: 621. Krisiloff M, Puchner PJ, Tretter W, et al. Pregnancy in women with bladder exstrophy. J Urol 1978; 119: 478. Burbage KA, Hensle TW, Chambers WJ, et al: Pregnancy and sexual function in bladder exstrophy. Urology 1986; 28: 12. Kennedy WA, Hensle TW, Riley EA. Pregnancy after orthotopic continent urinary diversion. Surg Obstet Gynecol 1993; 177: 405. Stein R, Fisch M, Bauer H, et al. Operative reconstruction in external and internal genitalia in female patients with bladder exstrophy and epispadias. J Urol 1995; 154: 1002. Mednick L, Gargollo P, Oliva M, et al. Stress and coping of parents of young children diagnosed with bladder exstrophy. J Urol 2009; 181: 1312. Meldrum KK, Mathews RI, Nelson CP, et al. Subspecialty training and surgical outcomes in children with failed bladder exstrophy closure. J Pediatr Urol 2005; 1: 95. Nelson CP, North AC, Ward MK, et al. Economic impact of failed or delayed primary repair of bladder exstrophy: differences in cost of hospitalization. J Urol 2008; 179: 680. Nelson CP, Dunn RL, Wei JT, et al. Surgical repair of bladder exstrophy in the modern era: contemporary practice patterns and the role of hospital case volume. J Urol 2005; 174: 1099. Sweetser TH, Chisolm TC, Thompson WH. Exstrophy of the urinary bladder: discussion of anatomic principles applicable to repair with a preliminary report of a case. Minn Med 1952; 35: 654. Cendron J. La réconstruction vésicale. Ann Chir Infant 1971; 12: 371. Jeffs RD, Charrios R, Mnay M, et al. Primary closure of the exstrophied bladder. In Scott R (ed): Current Controversies in Urologic Management. Philadelphia:WB Saunders, 1972; 235. Williams DI, Keaton J. Vesical exstrophy: Twenty years' experience. Br J Surg 1973; 60: 203. Gearhart JP, Jeffs RD. State of the art reconstructive surgery for bladder exstrophy at the Johns Hopkins Hospital. Am J Dis Child 1989; 143: 1475. Grady R, Mitchell ME. Complete repair of exstrophy. J Urol 1999; 162: 1415. Chan DY, Jeffs RD, Gearhart JP. Determinants of continence in the bladder exstrophy population: predictors of success? Urology 2001; 57: 774. Stein R, Fisch M, Black P. Strategies for reconstruction after unsuccessful or unsatisfactory primary treatment of patients with bladder exstrophy and incontinent epispadias. J Urol 1999; 161: 1934. Grady RW, Mitchell ME. Surgical techniques for one-stage reconstruction of the exstrophy-epispadias complex. In: Wein AJ, Kavoussi LR, Novick AC, Partin AW, Peters CA (eds). Campbell-Walsh Urology. Philadelphia: Saunders; 2007, p. 3497. Husmann DA. Surgery Insight: advantages and pitfalls of surgical techniques for the correction of bladder exstrophy. Nat Clin Prac Urol 2006:3:95. Kibur Y, Roth CC, Frimberger D, et al. Our initial experience with the technique of complete primary repair for bladder exstrophy. J Pediatr Urol 2009; 5: 186. Mitchell ME. Bladder exstrophy repair: complete primary repair of exstrophy. Urology 2005; 65: 5. Gargollo PC, Borer JG, Diamond DA, et al. Prospective followup in patients after complete primary repair of bladder exstrophy. J Urol 2008; 180: 1665. Kibur Y, Roth CC, Frimberger D, et al. Our initial experience with the technique of complete primary repair for bladder exstrophy. J Pediatr Urol 2009; 5: 186. Shnorhavorian M, Grady RW, Anderson A, et al. Long-term followup of complete primary repair of exstrophy: The Seattle Experience. J Urol 2008; 180: 1615. Hafez AT and El-Sherbiny MT. Complete repair of bladder exstrophy: management of resultant hypospadias. J Urol 2005; 173: 958-961. Gearhart JP,Baird AD. The failed complete repair of bladder exstrophy: insights and outcomes. J Urol 2005; 174: 1669-. Gargollo PC and Borer JG. Contemporary outcomes in bladder exstrophy. Curr Opin Urol 2007; 17: 272-280. Mathews RI, Gan, M, Gearhart JP. Urogynaecologic and obstetric issues in women with the exstrophy-epispadias complex. BJU Int 2003; 91: 845. Shapiro E, Jeffs RD, Gearhart JP, et al. Muscarinic cholinergic receptors in bladder exstrophy: Insights into surgical management. J Urol 1985; 134: 309. Lee BR, Perlman EJ, Partin AW, et al. Evaluation of smooth muscle and collagen subtypes in normal newborns and those with bladder exstrophy. J Urol 1996; 156: 203. Peppas DS, Blanche-Tijien M, Perlman E, et al: A quantitative histology of the bladder in various stages of reconstruction utilizing color morphometry. In Gearhart JP, Mathews RI (eds): Exstrophy-Epispadias Complex: Research Concepts and Clinical Applications. New York, Plenum, 1999:41. Lais A, Paolocci N, Ferro N, et al. Morphometric analysis of smooth muscle in the exstrophy-epispadias complex. J Urol 1996; 156: 819. Orsola A, Estrada CR, Nguyen HT, et al. Growth and stretch response of human exstrophy bladder smooth muscle cells: molecular evidence of normal intrinsic function. BJU Int 2005; 95: 144. Mathews RI, Wills M, Perlman E, et al. Neural innervation of the newborn exstrophy bladder: An immunohistological study. J Urol 1999; 162: 506. Rosch W, Christl A, Strauss B, et al. Comparison of preoperative innervation pattern and post reconstructive urodynamics in the exstrophy-epispadias complex. Urol Int 1997; 59: 6. Hipp J, Andersson KE, Kwon TG, et al. Micoarray analysis of exstrophic human bladder smooth muscle. BJU Int 2008; 101: 100. Novak TE, Lakshmanan Y, Frimberger D. et al. Polyps in the exstrophic bladder. A cause for concern? J Urol 2005; 174: 1522. Toguri AG, Churchill BM, Schillinger JF, et al. Continence in cases of bladder exstrophy. J Urol 1987; 119: 538. Diamond DA, Bauer SB, Dinlenc C, et al. Normal urodynamics in patients with bladder exstrophy: Are they achievable? J Urol 1999; 162: 841. Mathews R, Gosling JA, Gearhart JP. Ultrastructure of the bladder in classic exstrophy-Correlation with development of continence. J Urol 2004; 172: 1446. Wakim A, Barbet JP. Connections of the bladder plate and bladder neck with the bony pelvis in a fetus with classic bladder exstrophy. Urology 2002; 60: 142. Gearhart JP. Failed bladder exstrophy closure: evaluation and management. Urol Clin North Am 1991; 18: 687. Connolly JA, Peppas DS, Jeffs RD, et al. Prevalence in repair of inguinal hernia in children with bladder exstrophy. J Urol 1995; 154: 1900. Baker LA, Gearhart JP. Staged approach to bladder exstrophy and the role of osteotomy. World J Urol 1998; 16: 205. Silver RI, Partin AW, Epstein JI, et al. Penile length in adulthood after bladder exstrophy reconstruction. J Urol 1997; 158: 999. Gearhart JP, Yang A, Leonard MP, et al. Prostate size and configuration in adult patients with bladder exstrophy. J Urol 1993; 149: 308. Silver RI, Partin AW, Epstein JI, et al: Prostate specific antigen in men born with bladder exstrophy. Urology 1997; 49: 253. Berkowitz J, Carter HB, Gearhart JP. Prostate cancer in patients with the bladder exstrophy-epispadias complex: insights and outcomes. Urology 2008; 71: 1064. Schlegel PN, Gearhart JP. Neuroanatomy of the pelvis in an infant with cloacal exstrophy: A detailed microdissection with histology. J Urol 1989; 141: 583. D'Hauwers KS, Feitz WF, Kremer JA. Bladder exstrophy and male infertility: pregnancies after ICSI with ejaculated or epididymal sperm. _ Fertil Steril_ 2008; 89: 387. Sponseller PD, Bisson LJ, Gearhart JP, et al. The anatomy of the pelvis in the exstrophy complex. J Bone Joint Surg Am 1995; 77: 177. Cadeddu JA, Benson JE, Silver RI, et al. Spinal abnormalities in classic bladder exstrophy. Br J Urol 1997:79:975. Stec AA, Pannu HK, Tadros YE, et al. Pelvic floor evaluation in classic bladder exstrophy using 3-dimensional computerized tomography-Initial insights. J Urol 2001; 166: 1444. Halachmi S, Farhat W, Konen O, et al. Pelvic floor magnetic resonance imaging after neonatal single stage reconstruction in male patients with classic bladder exstrophy. J Urol 2003; 170: 1505. Gargollo PC, Borer JG, Retik AB, et al. Magnetic resonance imaging of pelvic musculoskeletal and genitourinary anatomy in patients before and after complete primary repair of bladder exstrophy. J Urol 2005; 174: 1559. Ebert AK, Falkert A, Brandl R, et al. Pelvic-floor imaging using three-dimensional ultrasonography and magnetic resonance imaging in the long term follow-up of the bladder-exstrophy-epispadias complex. BJU Int 2010; 105: 248. Ives E, Coffey R, Carter CO. A family study of bladder exstrophy. J Med Genet 1980; 17: 139. Reutter H, Qi L, Gearhart JP, et al. Concordance analyses of twins with bladder exstrophy-epispadias complex suggest genetic etiology. Am J Med Genet Part A 2007;143A:2751. Boyadijiev SA, Dodson JL, Radford CL, et al. Clinical and molecular characterization of the bladder exstrophy-epispadias complex: analysis of 232 families. BJU Int 2004; 94: 1337. Wood HP, Trock BP, Gearhart JP. In vitro fertilization and the cloacal-bladder exstrophy-epispadias complex: Is there an association? J Urol 2003; 169: 1512. Wood HM, Babineau D, Gearhart JP. In vitro fertilization and the cloacal/bladder exstrophy-epispadias complex: a continuing association. J Pediatr Urol 2007; 3: 305. Boyadijiev S, South S, Radford C, et al. Characterization of reciprocal translocation 46XY,t(8;9)(p11.2;13) in a patient with bladder exstrophy identifies CASPR3 as a candidate gene and shows duplication of the regions flanking the pericentric heterochromatin on chromosome 9 in normal population. Presented at American Society of Genetics, Oct. 29, 2004, Toronto, Canada. Reutter H, Thauvin-Robinet C, Boemers TM, et al. Bladder exstrophy-epispadias complex: Investigation of suppressor of variegation, enhancer of zeste and Trithorax (SET) as a candidate gene in a large cohort of patients. Scand J Urol Nephrol. 2006; 40: 221. Boyadjiev SA, South ST, Radford CL, et al. A reciprocal translocation 46,XY,t(8;9)(p11.2;q13) in a bladder exstrophy patient disrupts CNTNAP3 and presents evidence of a pericentromeric duplication on chromosome 9. Genomics 2005; 85: 622. Ludwig M, Ruschenforf F, Saar K, Hubner N, Siekmann L, Boyadjiev SA, Reutter H. Genome-wide linkage scan for bladder exstrophy-epispadias complex. Birth Defects Res A Clin Mol Teratol. 2009 Feb;85(2):174-8. Gearhart JP, Ben Chaim J, Jeffs RD. Criteria for prenatal diagnosis of bladder exstrophy. Obstet Gynecol 1995; 85: 961. Gobbi D, Fascetti LF, Tregnaghi A, et al. Early prenatal diagnosis of cloacal exstrophy with fetal magnetic resonance imaging. Fetal Diagn Ther 2008; 24: 437. Lattimer JK, Smith MJK: Exstrophy closure: a follow-up on 70 cases. J Urol 1966; 95: 356. Lancaster PAL: Epidemiology of bladder exstrophy: A communication from the International Clearinghouse for Birth Defects monitoring System. Teratology 36:221, 1987. Nelson CP, Dunn RL, Wei JT. Contemporary epidemiology of bladder exstrophy in the United States. J Urol 2005; 173: 1728. Shapiro E, Lepor H, Jeffs RD. The inheritance of classic bladder exstrophy. J Urol 1984; 132: 308. Ives E, Coffey R, Carter CO. A family study of bladder exstrophy. J Med Genet 1980; 17: 139. Lancaster PA. Epidemiology of bladder exstrophy: A communication from the International Clearinghouse for Birth Defects monitoring System. Teratology 1987; 36: 221. Ambrose SS, O'Brian DP. Surgical embryology of the exstrophy-epispadias complex. Surg Clin North Am 1974; 54: 1379. Marshall VF, Muecke C. Congenital abnormalities of the bladder. In Handbuch der Urologie. New York: Springer Verlag, 1968; p. 165. Mildenberger H, Lkuth D, Dziuba M. Embryology of bladder exstrophy. J Pediatr Surg 1988; 23: 116. Johnson JH, Kogan SJ. The exstrophic anomalies and their surgical reconstruction. Curr Prob Surg 1974 (August):1-39.









