Desordenes del Desarrollo Sexual (DSD) — Aspectos Urológicos
John M. Hutson
Departamento de Urología, Royal Children's Hospital, Parkville , Victoria, AUSTRALIA
Traducido y editado desde el original al español | Enlace a la versión en inglés
Francisca Yankovic
Hospital Exequiel Gonzalez Cortes, Santiago Chile
Introducción
Los trastornos del desarrollo sexual (DSD) son un grupo complejo de condiciones que afectan los genitales internos y/o externos. Debido a que tienden a ser complejos e infrecuentes, el tratamiento se debe realizar mediante un equipo regional de expertos, que pueden mantener su experiencia mediante la exposición frecuente. El urólogo pediátrico es una parte esencial de este equipo y puede contribuir a comprender la embriología, así como la anatomía genital en el momento de la presentación. Este capítulo describe estas diversas áreas junto con los principios del tratamiento quirúrgico. Para un tratado completo sobre DSD, el lector puede consultar nuestro libro sobre DSD ( Hutson, Warne y Grover, 2012).
Embriología normal
Durante el desarrollo embrionario temprano, la cresta urogenital se forma a partir del mesodermo intermedio como una protuberancia longitudinal en la pared posterior de la cavidad pleuroperitoneal 1,2. Originalmente, unos pocos túbulos se forman al final de la cresta urogenital y luego regresan como pronefros transitorios. En el momento en que se forma el diafragma para crear la cavidad abdominal, el mesonefros o el riñón medio se ha desarrollado y se ha hecho cargo de la mitad inferior del conducto pronéfrico, por lo que se convierte en el conducto mesonéfrico o wolffiano. En la superficie anteromedial del mesonefros, el mesénquima se condensa para formar la gónada totipotencial, hacia la cual las células germinales primitivas migran desde la región del tallo del saco vitelino del alantoides. Cerca del polo craneal de la gónada, la superficie peritoneal sobre el borde libre lateral de la cresta urogenital se evagina para formar el conducto paramesonéfrico o mülleriano, que luego se alarga caudalmente hacia la cloaca que sigue al conducto wolffiano. Caudalmente, las crestas urogenitales ruedan medialmente para que sus bordes libres, se posicionen entre sí, permitiendo que los conductos se fusionen, para crear el primordio uterovaginal. El extremo caudal de los conductos fusionados, que es un cordón sólido, migra a la cloaca anterior entre los conductos de Wolff para estimular la proliferación del endodermo del bulbo y formar el bulbo sinovaginal. En las mujeres, la proliferación adicional de este endodermo se extiende caudalmente desde el primordio uterovaginal hacia el exterior, inmediatamente detrás de la uretra primitiva.
El desarrollo sexual de los genitales internos comienza a las 7-8 semanas de gestación. La expresión de SRY en los hombres desencadena una cascada de diferenciación en la gónada totipotencial para formar un testículo 3. La producción temprana de hormona antimulleriana (AMH; también llamada sustancia inhibidora mülleriana, MIS) causa la regresión de los conductos de Müller, mientras que la testosterona de las células de Leydig se secreta como una hormona exocrina en los conductos de Wolff para desencadenar el desarrollo del epidídimo cranealmente, vas deferentes caudales y brotes del conducto de Wolff distal para producir la vesícula seminal 4. La testosterona también ingresa a la sangre como una hormona endocrina para llegar a los genitales externos, donde es convertida por una enzima, la 5 alfa-reductasa, en dihidrotestosterona (DHT) 5. DHT se une 5-10 veces más fuertemente a los receptores de andrógenos que la testosterona en sí. Los andrógenos circulantes, a través de DHT, masculinizan los genitales externos a las 8-12 semanas. El tubérculo genital se agranda, mientras que la placa uretral endodérmica se canaliza para formar una uretra que se extiende inicialmente al futuro surco coronal (~ 12 semanas) y, finalmente, a la punta del glande (~ 15-20 semanas). Los pliegues genitales internos y externos crecen sobre la placa uretral para formar los tejidos periuretrales y el escroto, y el primordio uterovaginal involuciona. Además, los andrógenos circulantes causan la regresión del ligamento craneal suspensorio de la gónada.
Las células de Leydig en desarrollo también producen una hormona parecida a la insulina 3 (Insuline like 3, IL3), que estimula el ligamento suspensorio caudal de la cresta urogenital, conocido como el ligamento genito-inguinal o "gubernaculum" 6,7,8. El gubernaculum finaliza en la pared abdominal anterior justo lateral al músculo recto del abdomen en desarrollo. Su extremo caudal se agranda en los hombres en respuesta a IL3. Además, su unión a la cresta urogenital y al polo inferior de la gónada (conocida como la cuerda) sigue siendo corta y gruesa, anclando así el testículo al futuro canal inguinal a medida que la cavidad abdominal fetal se agranda con el crecimiento 9. Este anclaje del testículo fetal entre las 8 y las 15 semanas de gestación provoca la primera fase de descenso testicular (transabdominal).
Hacia aproximadamente las 25 semanas de gestación, el testículo fetal comienza a descender como parte de la fase inguino-escrotal de descenso. La migración al escroto requiere que el gubernaculum se alargue más allá del anillo inguinal externo, a través de la región púbica y hacia el escroto, probablemente controlado por el nervio genitofemoral. Este último, está regulado por los andrógenos, que estimulan la liberación de un neurotransmisor, el péptido relacionado con el gen de la calcitonina (CGRP), de las ramas sensoriales del nervio para proporcionar un gradiente químico para que siga el gubernaculum. Después de que se completa el descenso, el CGRP también regula la obliteración del proceso vaginal proximal para prevenir la persistencia de este y una posible hernia inguinal.
En las mujeres, el desarrollo genital procede inicialmente sin hormonas. La ausencia de AMH permite que los conductos de Müller se diferencien en trompas de Falopio, útero y vagina superior, mientras que la falta de testosterona no solo permite que los genitales externos conserven su forma femenina, sino que también permite el desarrollo vaginal y su canalización. Sin andrógenos, la placa uretral del tubérculo genital futuro sufre apoptosis, acortando así la superficie ventral para producir la horquilla 10. El mesonefros en regresión deja las gónadas en un mesenterio, que en las mujeres se convierte en el mesovario y el resto de la cresta urogenital se desarrolla en el ligamento ancho, para anclar el tracto genital femenino en la pelvis 11. En el ovario en desarrollo, el gubernáculo femenino se alarga en proporción al crecimiento fetal, y eventualmente se convierte en el ligamento del ovario y el ligamento redondo.
Variación de la embriología
La diferenciación testicular atípica se produce por alteraciones de las hormonas que controlan la diferenciación sexual 12. Cuando la anomalía afecta la cantidad de hormonas testiculares, el grado de masculinización, tanto interna como externa, es proporcional a los niveles funcionales de testosterona, AMH e Insl3 que se producen. La cantidad de señal androgénica efectiva (a través de DHT) se puede determinar a partir de los genitales externos, que son en efecto un "bioensayo" para el efecto androgénico 13.
En anomalías cromosómicas complejas, como la aneuploidía y el mosaicismo, puede haber desarrollo testicular asimétrico. En el mosaicismo de los cromosomas sexuales, la diferenciación gonadal está determinada por el número de células en la gónada totipotencial que contienen un cromosoma Y, con expresión SRY normal. Es común que el porcentaje de células que contienen un cromosoma Y varíe en cada cresta urogenital, por lo que el desarrollo testicular puede ocurrir solo en un lado. Debido a que los conductos genitales internos responden a las hormonas exocrinas del testículo ipsilateral, el conducto de Wolff se conservará en el lado de un testículo, mientras que el conducto de Müller estará ausente en este mismo lado a medida que los testículos controlan su propio descenso (a través de Insl3, AMH y testosterona).
La insuficiencia placentaria puede causar genitales atípicos. En el pasado, estas alteraciones eran invisibles debido a la muerte fetal en el útero o las muertes postnatales tempranas en recién nacidos extremadamente prematuros. Los efectos de la insuficiencia placentaria se observan ahora en algunos pacientes sobrevivientes nacidos con 24-26 semanas de gestación con retraso grave del crecimiento intrauterino (RCIU), donde se pensó que la falla en la producción temprana de hormonas testiculares se debía a la falta de gonadotropina coriónica (hCG) 5 de la placenta anormal. Los pacientes tienen RCIU y genitales atípicos con testículos parcialmente descendidos, pero ninguna otra anomalía hormonal después del nacimiento. La falla de crecimiento prenatal significa que muchos de estos niños son pequeños, y aunque el crecimiento de recuperación se produce durante la infancia, algunos necesitan hormona de crecimiento.
Las anomalías del eje hipotálamo-hipófisis-gonadal causan micropene y criptorquidia. En estos trastornos, el recién nacido tiene genitales externos completamente masculinizados (8-12 semanas), pero la falla del crecimiento del tubérculo genital entre 15 y 40 semanas, lo que lleva a micropene 14. Esto se debe a que la diferenciación sexual inicial es normal, ya que el testículo en desarrollo es estimulado por la hCG de la placenta hasta que el eje hipotalámico toma el control aproximadamente a las 15 semanas de gestación. Esto conduce a andrógenos circulantes normales entre 8 y 15 semanas, pero a partir de entonces andrógenos deficientes. Las dos características restantes de la anatomía masculina que se desarrollan después de esto, es decir, el agrandamiento fálico y el descenso testicular inguinoscrotal, son las únicas cosas que se alteran.
La función de los andrógenos se ve alterada por varias mutaciones enzimáticas y del receptor específicas. Un ejemplo clásico es el paciente con síndrome de insensibilidad a los andrógenos (CAIS), donde el receptor de andrógenos no es funcional 15. La anatomía genital externa es la de una mujer normal, aparte de la presencia de testículos en la región inguinal (dentro del canal inguinal o justo fuera del anillo inguinal externo), ya que la primera fase del descenso testicular es normal mientras que la segunda fase está completamente bloqueada. Además, la función de la AMH es normal, por lo que los conductos de Müller han involucionado, aunque el desarrollo vaginal inferior es normal, ya que el primordio uterovaginal se forma en ausencia de andrógenos 16,17.
Las mutaciones específicas en enzimas o receptores que controlan las otras hormonas testiculares causan trastornos anatómicos aislados. La síntesis de IL3 o las anomalías del receptor IL3, por ejemplo, producirían testículos no descendidos, pero son poco frecuentes. Sin embargo, los disruptores endocrinos en el entorno materno pueden explicar algunos casos, ya que los estrógenos exógenos suprimen IL3. Las mutaciones en la señalización de AMH también conducen a un síndrome infrecuente, conocido como síndrome de conducto de Müller persistente (PMDS) 18,19,20. En esta anormalidad, el desarrollo genital externo es normal en los hombres, pero los testículos no descienden y los conductos de Müller persisten como un útero infantil, tubos y vagina superior (que entran en la uretra posterior cerca del verumontanum). La causa de la criptorquidia se discute, y muchos autores sugieren que el útero retenido y los ligamentos amplios evitan el descenso 21. Sin embargo, el cordón del gubernaculum es anormalmente largo, lo que sugiere que la AMH tiene algún papel en impedir el alargamiento del cordón gubernacular, al menos en humanos, ya que esto no se observa en roedores 18,19,20. Un corolario importante del vínculo entre la AMH y el descenso testicular es el hecho de que cuando se produce un descenso transabdominal del testículo (de modo que el testículo es palpable), podemos predecir con confianza que el conducto de Müller (en ese lado) está involucionado 13 .
Examen clínico y reglas para el diagnóstico
El examen clínico de un recién nacido con sospecha de DSD incluye una historia detallada del embarazo y la familia. La historia familiar puede revelar una anomalía hereditaria con un patrón autosómico recesivo o ligado al X, como la insensibilidad androgénica. Los posibles factores prenatales en la madre o en su entorno (p. Ej., Ingestión de esteroides, tumores secretores de hormonas, disfunción placentaria) también pueden interferir con el desarrollo sexual en el feto.
El examen físico de los genitales requiere una serie de características que deben determinarse, utilizando algunas reglas simples derivadas de nuestro conocimiento del desarrollo normal (## Tabla 1) 13. Claramente, un examen general incluirá una búsqueda de otras anomalías y posibles características sindrómicas, ya que una serie de síndromes malformativos están asociados con DSD 22. El examen genital debe concentrarse en lo siguiente:
- Establezca el grado de masculinización, que se realiza fácilmente utilizando la puntuación de Prader de 0 a 5. Esto determina la cantidad de andrógeno activo al que estuvo expuesto el recién nacido, ya que el grado de virilización es directamente proporcional a la cantidad de andrógenos 23.
- Prader: O: apariencia femenina normal
- 1-4: masculinización creciente
- 5: apariencia masculina normal
- Determine el sitio, la forma y los contenidos de la abertura urogenital. Los pliegues labio-escrotales se deben abrir para examinar el seno urogenital. En los niños con hipospadias simples, no solo se fusiona el escroto y contiene dos testículos descendentes, sino que el meato uretral suele ser pequeño. Por el contrario, en los bebés con DSD que causan insuficiencia androgénica, la abertura urogenital es una abertura en forma de embudo. En el vértice de este embudo puede ser posible ver la confluencia uretral y vaginal, que está marcada por el himen. Este último es fácilmente reconocible, ya que su mucosa es de un color rosado azulado ligeramente más pálido en contraste con la mucosa uretral de color rojo brillante. El color azul pálido del himen al nacer es el resultado de la estimulación de los estrógenos maternos.
- Determine la presencia y el sitio de las gónadas. La palpación confirmará su consistencia normal (o anormal) y también permite identificar cualquier el epidídimo o conducto deferente. Cuando las gónadas no son palpables, debe palpar el sitio del anillo inguinal externo. Si esto es palpable como un defecto triangular, entonces es muy probable que haya una gónada presente dentro del canal inguinal. Por el contrario, si el anillo está completamente cerrado, es improbable que la gónada esté dentro del canal y sugiere que es intraabdominal, ya sea como un testículo muy displásico o disgenético o una cintilla o simplemente es un ovario (que nunca desciende como carece de las hormonas testiculares que controlan el descenso).
- Solicitar una ecografía de la pelvis para ver si se pueden ver los ovarios y los conductos femeninos.
Manejo
El tratamiento quirúrgico de las variaciones genitales presentes en la DSD requiere un alto grado de experiencia. No solo la cirugía en sí necesita una habilidad considerable en los procedimientos reconstructivos, sino también porque el resultado debe ser lo suficientemente bueno como para soportar la evaluación crítica de un adulto después 24,25 Después del diagnóstico de la hiperplasia suprarrenal congénita en 1953, hubo una explosión de nuevas técnicas para tratarla y muchos procedimientos se idearon en la década de 1960,
Posteriormente, en las décadas de 1970 y 1980 se observaron resultados cosmético y funcionales relativamente malos cuando esa cohorte de pacientes alcanzó la edad adulta 26. Esto llevó al establecimiento de muchos grupos de apoyo para pacientes, lo que llevó en algunos lugares del mundo a una moratoria sobre la cirugía genital en bebés 27,28.
Los malos resultados iniciales a largo plazo desencadenaron una reevaluación radical del manejo, con el establecimiento de centros regionales de excelencia para permitir la concentración y el mantenimiento de la experiencia y las habilidades multidisciplinares. Como en muchos aspectos de la cirugía pediátrica, el problema básico aquí fue el largo intervalo entre la intervención (cirugía en la primera infancia / infancia) y el resultado funcional, estético y mental medido en la edad adulta y la capacidad de estas personas para tener una vida sexual satisfactoria. En los primeros 20-30 años de cirugía DSD no hubo comentarios importantes de adultos, excepto en casos anecdóticos, pero ahora se ha reemplazado con estudios de seguimiento cada vez más formalizados, para que los aspectos de los diferentes enfoques se puedan asimilar en un plan común de manejo 29,30,31. En nuestra propia institución, la primera revisión a largo plazo se realizó en la década de 1980 y esto identificó una serie de problemas importantes, que se enumeran a continuación.
- los niños tuvieron pesadillas sobre el examen genital frecuente (y a menudo público) en policlínicos ambulatorios, por lo que inmediatamente modificamos la práctica para obtener el consentimiento informado (del niño, si es posible) y la privacidad y discreción adecuadas. Actualmente limitamos el examen genital a la infancia tardía, si es que existe alguna indicación de realizarlo.
- Las dilataciones vaginales postoperatorias fueron traumáticas (tanto física como mentalmente) para los niños y los padres, y no son necesarias. Detuvimos esto en la década de 1980 y desarrollamos medidas preventivas más agresivas contra la infección de la herida perineal (cobertura de antibióticos, ungüento antiséptico y baños de sal).
- El seguimiento regular por parte del cirujano tratante proporcionó un apoyo moral inestimable para los niños que crecían, ya que tenían un contacto regular con la persona que más sabía sobre su diagnóstico y anatomía. Esto sigue siendo una parte importante de nuestro plan de tratamiento actual.
- La exposición temprana (durante la infancia) al ginecólogo adolescente fue de gran ayuda tanto para los padres como para las niñas con DSD, ya que la transición a la atención de adultos fue facilitada por una cadena ininterrumpida. Actualmente presentamos a nuestras pacientes al ginecólogo adolescente entre los 9 y los 11 años.
- La divulgación abierta no solo desmitificó las complejidades médicas del diagnóstico, sino que también permitió que la DSD se manejara como cualquier otro problema médico crónico, en lugar de algo secreto y vergonzoso o de naturaleza extraña. Comenzamos con la divulgación a los padres, y apreciamos rápidamente que cuanto antes los niños comiencen a comprender los problemas subyacentes, menos perturbado será el desarrollo de su personalidad. La discusión abierta del problema con el vocabulario específico de la edad durante la infancia y posteriormente mediante explicaciones más formales de la biología en la infancia tardía o la adolescencia temprana.
- La consejería continua, tanto informal como formal fue una necesidad absoluta, basada en nuestra creciente conciencia del cerebro como el órgano más importante de la sexualidad.
Sincronización
A pesar del debate en muchos centros sobre cómo evitar la cirugía irreversible en la infancia (consulte el capítulo adjunto de Garry Warne), continuamos ofreciendo una intervención temprana con un consentimiento totalmente informado, si ese es el deseo de los padres. Esto se debe a que el seguimiento a largo plazo muestra que sólo alrededor del 12% de las niñas necesitan cirugía adicional en la adolescencia (presentada en la reunión internacional de DSD, Gent, Bélgica, junio de 2015).
Para la genitoplastía femenina, actualmente recomendamos la cirugía entre 6 semanas y 6 meses 32. Esto permite tiempo para un diagnóstico completo y asesoramiento, sin que los padres sientan que se les está presionando. La clitoromegalia retrocede algo después del comienzo de la cortisona y la supresión secundaria de la producción anormal de andrógenos. Al cabo de unos pocos meses se producirá una pequeña contracción adicional y se utilizará la cirugía para reducir el clítoris. Más allá de los 12 meses entran en juego otros factores, como el bebé gateando y caminando, que corre el riesgo de traumatismo en los genitales después de la operación si se produce una caída (¡lo cual es común!). Además, los tejidos son fáciles de manipular a esta edad y la cicatrización es rápida, siempre que se pueda evitar la infección superficial y la rotura de la herida perineal peri operatorio adecuado.
En el caso de los niños, generalmente comenzamos la reconstrucción entre los 3 y 6 meses, por lo que se pueden realizar etapas adicionales (y se espera que se completen) a los 18 meses de edad, cuando los recuerdos permanentes de ingreso en el hospital y la cirugía genital podría ser un problema.
Genitoplastía femenina
En nuestro centro la reconstrucción quirúrgica, más comúnmente en los bebés con CAH, incluye 3 principios básicos 33,34,35,36.
- Clitoroplastia para reducir el exceso de tejido eréctil de los cuerpos cavernosos y reducir el tamaño del glande, a la vez que preserva el suministro neurovascular para que la función sexual posterior sea lo más normal posible. Existen numerosos métodos para la clitoroplastia, pero hemos seguido utilizando una modificación del método utilizado por primera vez en nuestro departamento por Robert Fowler a principios de los años 70. Esta técnica elimina el exceso de tejido eréctil ventral y recrea la curva normal de la horquilla en el clítoris, y evita cualquier disección en la superficie dorsal cerca de los haces neurovasculares 37. Nuestros resultados continúan apoyando este enfoque contra el método alternativo de aislamiento de los haces neurovasculares para permitir la escisión del eje del falo: este último método tiene un mayor riesgo de isquemia del glande o pérdida sensorial que comprometería seriamente la función sexual del adulto 25,30. El único buen argumento en contra de nuestro enfoque es el riesgo de agrandamiento de los cuerpos cavernosos en la adolescencia si la supresión de los esteroides es inadecuada.
- Creación de un introito de aspecto normal con labios menores y labios mayores. La cubierta exterior del prepucio alrededor del clítoris se utiliza en parte para crear labios menores, mientras que el prepucio interno se deja como una cubierta para el glande del clítoris recién reconstruido 38.
- El tercer objetivo de la reconstrucción genital es una vaginoplastia, para proporcionar una abertura adecuada en el introito vaginal 39,40. Esto evita la acumulación de orina en la vagina si se deja intacto el seno urogenital común, y permite el uso normal de tampones en la adolescencia, con o sin una pequeña dilatación controlada por el paciente en ese momento. Hay muchos enfoques para la vaginoplastia, desde la plastia YV simple hasta la operación de Passerini 40, el descenso en bloque del seno urogenital pacial (PUM) y la movilización completa (TUM).
Genitoplastía masculina
Los varones con genitales atípicos pueden tener hipospadias proximales, y aquí es útil una reconstrucción en etapas. Los principios de reparación de hipospadias casi no necesitan énfasis en este capítulo, ya que son similares a los de otras partes de este texto. Sin embargo, hay algunas diferencias menores que vale la pena mencionar.
Durante el primer procedimiento, la endoscopia es útil para identificar la presencia de remanentes mullerianos, ya que puede ser necesario extirparlo en caso de goteo post miccional post uretroplastía. Además, es posible que se requiera una laparoscopia para documentar con precisión la anatomía interna. También hemos utilizado la laparoscopia para separar el remanente vaginal de la uretra, pero sin escisión, de modo que la reparación temprana de las hipospadias no se vea comprometida por la acumulación de orina en la vagina, pero se deja la opción abierta en el futuro en caso de disforia de género. En ocasiones se realizan en forma concomitante el descenso testicular y/o biopsia gonadal.
Después de un intervalo de 6 meses, procederíamos a la uretroplastia y la corrección de la transposición penoscrotal, junto con la reparación del escroto bífido. Además, en algunos pacientes, la conexión entre el remanente vaginal y el seno urogenital es tan baja que se puede alcanzar fácilmente desde el perineo abriendo la parte anterior del cuerpo perineal. El remanente vaginal puede extirparse completamente o desconectarse y dejarse in situ, y en ocasiones es suficiente la extirpación de la mucosa. Este último es relativamente simple y disminuye el riesgo de daño involuntario en el recto.
Tablas
Tabla 1
| Regla No | Regla | Implicación |
|---|---|---|
| 1 | Los testículos descienden, los ovarios no | Una gónada palpable es un testículo |
| 2 | Descenso testicular + regresión del conducto de Muller vinculado | Una gónada palpable significa que el conducto de Müller ipsilateral ha retrocedido |
| 3 | Útero presente = células de Sertoli deficientes / ausentes (PR o ecografía) | Los conductos de Müller persistentes solo ocurren cuando el testículo está ausente o es disgenético (o PMDS raro) |
| 4 | Los conductos internos reflejan la gónada ipsilateral | MD / WD controlado por hormonas exocrinas ipsilaterales de un testículo |
| 5 | Los andrógenos circulatorios (suprarrenales) no pueden masculinizar el conducto de Wolff | Niveles de andrógenos suprarrenales (en CAH) demasiado bajos a las 8 semanas y sin secreción exocrina por debajo de WD |
| 6 | Los genitales externos se masculinizan proporcionalmente a la exposición a los andrógenos | Agrandamiento del clítoris (tejido eréctil, no solo prepucio) causado únicamente por andrógenos |
| 7 | Desarrollo masculino externo inversamente proporcional a menor regresión vaginal | El remanente vaginal estará presente genitales ambiguos |
| 8 | Masculinización externamente completa a las 12 semanas, pero el pene en crecimiento necesita andrógenos hasta 40 semanas | Los andrógenos ausentes después de esto (en defectos hipotalámicos) causan micropene y UDT |
| 9 | “Hipospadias” asume el género masculino, por lo tanto, utilícelo solo si el escroto se fusiona y los testículos descienden | hipospadias ’= niño con hormonas normales y anomalía local del desarrollo uretral. Si se requiere UDT / escroto bífido diagnóstico completo DSD |
| 10 | Anomalías genitales no hormonales fuera del espectro estrecho de hombre a mujer | Las anomalías anatómicas perineales incluyen los genitales y otras características (p. Ej., Defectos de la pared abdominal o anorrectales) |
Figuras
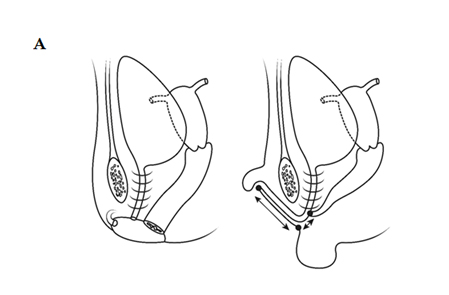
Figura 1. A) Anatomía relativa de una mujer normal frente a una mujer virilizada en CAH, con masculinización de la uretra anterior que empuja la abertura del perineo hacia adelante, aunque la unión entre el seno urogenital y la vagina permanece bastante cerca de la superficie.
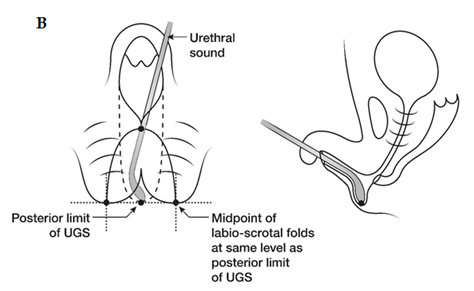
Figura 2. B) Marcado de los colgajos de piel para vaginoplastia (V-Y) utilizando un sonido para marcar el límite posterior del seno urogenital masulinizado. Esto marca la base del colgajo de piel para que se alinee con la vagina y el límite posterior de los pliegues labio-escrotales.
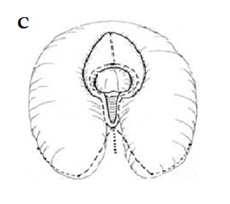
Figura 3. C) Incisiones cutáneas para clitoroplastia, vaginoplastia y labios redundantes.
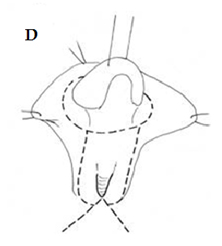
Figura 4. D) Mantén las suturas en el glande y el prepucio. Las líneas de incisión en la superficie ventral se muestran en detalle en relación con la tira mucosa ventral del seno urogenital y con la vaginoplastia (Y-V).
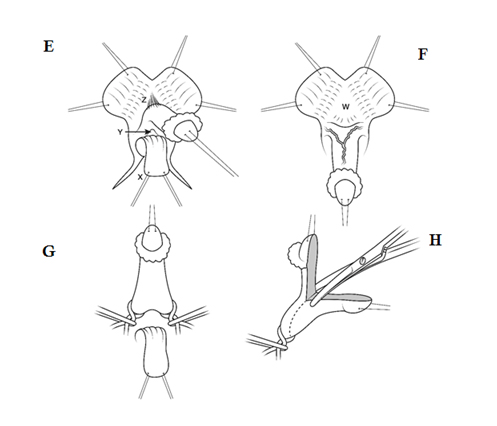
Figura 5. E) Movilización ventral del eje fálico para liberar la tira mucosa urogenital (X) y proteger la uretra subyacente por donde pasa entre los pilares (Y). Movilización dorsal de la piel del eje para exponer y dividir el ligamento suspensorio (Z). F) Tracción caudal sobre el falo para exponer la bifurcación de los pilares y el periostio de la sínfisis del pubis (W). Se empuja un divulgador en ángulo recto a través de la bifurcación, con cuidado de evitar la uretra, para aplicar torniquetes de catéter de goma en cada pilar. G) Torniquetes alrededor de cada pilar, mostrando la tira mucosa y la uretra retraída a un lugar seguro. H) Se reseca la porción anterior de la diáfisis y el glande con control de torniquete, evitando los nervios y vasos dorsales. El volumen adicional se puede eliminar “fileteando” el tejido eréctil de la superficie del corte.
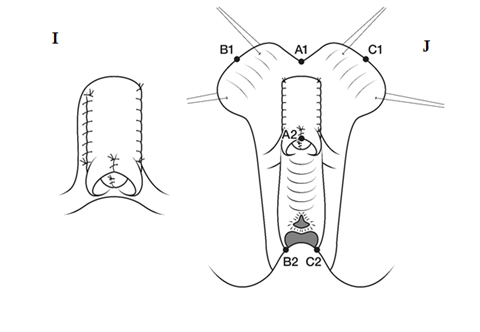
Figura 6. I) Sutura del falo en la curva de la horquilla aproximando las superficies en bruto (excluyendo el área frenular distal) y suturando los bordes cortados laterales opuestos de la túnica. J) Falo plegado suturado al periostio púbico. El pliegue anterior de la línea media de la piel del clítoris se sutura al eje. El borde de la piel (A1) se sutura al reborde de la piel subcoronal (A2). Los colgajos prepuciales se suturan a lo largo de cada lado de la tira de mucosa vestibular reinstalada para simular los labios menores (B1-B2, C1-C2).
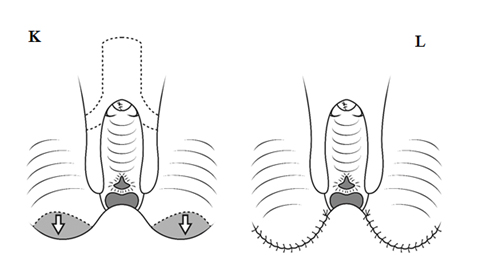
Figura 7. K) La eliminación del extremo posterior de los pliegues labioescrotales. L) Resultado final al final de la operación. También se muestran el colgajo de vaginoplastia Y-V y la escisión de la piel labial redundante.
Referencias
-
Hutson, J .: Desarrollo del sistema urogenital. En: Grey's Anatomy (4ª ed.). Editado por S. Standring. Londres, vol. Capítulo 78, pp. 1305-1325, 2008 ↩
-
Stephens, F., Smith, E., Hutson, JM .: Anomalías congénitas del riñón, tracto urinario y genital, 2ª edición, Martin Dunitz, Londres, 2002 ↩
-
Warne , GL, Kanumakala, S .: Endocrinología molecular de la diferenciación sexual. Semin Reprod Med, 20: 169, 2002 ↩
-
Tong, SY, Hutson, JM, Watts, LM: ¿Se difunde la testosterona por el conducto wolffiano durante la diferenciación sexual? J Urol, 155: 2057, 1996. ↩
-
Grumbach, M., Hughes, I., Conte, F .: Trastornos de la diferenciación sexual. En: Williams Textbook of Endocrinology, 10ª ed. Editado por KH Larsen PR, Melmed S, Polonsky KS. Filadelfia: WB Saunders, págs. 842-968, 2003 ↩ ↩2
-
Nef, S., Parada, LF: Criptorquidia en ratones mutantes para Insl3. Nat Genet, 22: 295, 1999 ↩
-
Zimmerman, S., Steding, G., Emmen, J. et al.: Alteración dirigida del gen INSL3 causa el ciprotiquismo bilateral. Mol. Endocrinol., 13: 681, 1999 ↩
-
Adham, IM, Agoulnik, AI: Señalización insulínica 3 en el descenso testicular. Int J Androl, 27: 257, 2004 ↩
-
Hutson, JM, Hasthorpe, S .: Descenso testicular y criptorquidia: el estado de la técnica en 2004. J Pediatr Surg, 40: 297, 2005 ↩
-
Penington, EC, Hutson, JM: La placa uretral - lo hace ¿Crecer en el tubérculo genital o dentro de él? BJU Int, 89: 733, 2002 ↩
-
Miller, A., Hong, MK, Hutson, J .: El ligamento ancho: una revisión de su anatomía y desarrollo en diferentes especies y ambientes hormonales. Clinical Anatomy, 17: 244, 2004 ↩
-
Clarnette, T., Sugita, Y., Hutson, JM .: Las anomalías genitales en los modelos humanos y animales revelan los mecanismos y hormonas que rigen el descenso testicular. Brit J Urol, 79: 99, 1997 ↩
-
Low, Y., Hutson, JM: Reglas para el diagnóstico clínico en bebés con genitales ambiguos. J Paediatr Child Health, 39: 406, 2003 ↩ ↩2 ↩3
-
Kaplan, SL, Grumbach, MM, Aubert, ML: La ontogénesis de las hormonas hipofisarias y los factores hipotalámicos en el feto humano: maduración de la regulación del sistema nervioso central de la función pituitaria anterior. Recent Prog Horm Res, 32: 161, 1976 ↩
-
Griffin, JE, Wilson, JD: Síndromes de resistencia a los andrógenos. Hosp Pract (Off Ed), 22: 159, 1987 ↩
-
Hutson, JM: Un modelo bifásico para el control hormonal del descenso testicular. Lancet, 2: 419, 1985 ↩
-
Hutson, JM: Feminización testicular: un modelo para el descenso testicular en ratones y hombres. J Pediatr Surg, 21: 195, 1986 ↩
-
Hutson, JM, Chow, CW, Ng, W .: Síndrome del conducto mulleriano persistente con extopía testicular transversa. Un experimento de la naturaleza con pistas para entender el descenso testicular. Pediatr Surg Int, 2: 191, 1987 ↩ ↩2
-
Hutson, JM, Davidson, P., Reece, L. y otros .: El fracaso del desarrollo gubernacular en el síndrome del conducto mulleriano persistente permite la herniación de los testículos. Pediatr Surg Int, 9: 544, 1994 ↩ ↩2
-
Hutson, JM, Baker, M .: Una hipótesis para explicar el descenso gonadal anormal en el síndrome de mullerianduct persistente. Pediatric Surgery International, 9: 542, 1994 ↩ ↩2
-
Josso, N., Fekete, C., Cachin, O. et al .: Persistencia de los conductos de Müller en el pseudohermafroditismo masculino y su relación con la criptorquidia. Clin Endocrinol (Oxf), 19: 247, 1983 ↩
-
Hutson, JM, Grover, SR, O'Connell, M., Pennell, SD Síndromes de malformación asociados con trastornos del desarrollo sexual. Nat Rev Endocrinol., 10 8 476-87 [^2014]. ↩
-
Vidal, I., Gorduza, DB, Haraux, E. y otros .: Opciones quirúrgicas en trastornos del desarrollo sexual (dsd) con genitales ambiguos. Best Pract Res Clin Endocrinol Metab, 24: 311 ↩
-
Houk, CP, Hughes, IA, Ahmed, SF y otros: Resumen de la declaración de consenso sobre los trastornos intersexuales y su manejo. Conferencia Internacional de Consenso Intersex. Pediatría, 118: 753, 2006 ↩
-
Lean, WL, Deshpande, A., Hutson, JM y otros: Resultados estéticos y anatómicos después de la cirugía de feminización para genitales ambiguos. J Pediatr Surg, 40: 1856, 2005 ↩ ↩2
-
Minto, CL, Liao, LM, Woodhouse, CR et al.: El efecto de la cirugía del clítoris sobre el resultado sexual en individuos que tienen afecciones intersexuales con genitales ambiguos: un estudio transversal. Lancet, 361: 1252, 2003 ↩
-
Rangecroft, L .: Manejo quirúrgico de genitales ambiguos. Arch Dis Child, 88: 799, 2003 ↩
-
Creighton, SM, Minto, CL, Steele, SJ: Resultados estéticos y anatómicos objetivos en la adolescencia de la cirugía de feminización para genitales ambiguos realizados en la infancia. Lancet, 358: 124, 2001 ↩
-
Warne, G., Grover, S., Hutson, JM et al.: Un estudio de resultados a largo plazo de las condiciones intersexuales. J Pediatr Endocrinol Metab, 18: 555, 2005 ↩
-
Crawford, JM, Warne, G., Grover, S. y otros: Los resultados de un centro quirúrgico pediátrico justifican la intervención temprana en trastornos del desarrollo sexual. J Pediatr Surg, 44: 413, 2009 ↩ ↩2
-
Hutson, JM, Warne, GL, Grover, SR Trastornos del desarrollo sexual: un enfoque integrado de la gestión. Springer, Berlín, 2012. ↩
-
Hrabovszky, Z., Hutson, JM: Tratamiento quirúrgico de las anomalías intersex: una revisión. Surgery, 131: 92, 2002 ↩
-
Hendren, WH: abordaje quirúrgico de los problemas intersexuales. Semin Pediatr Surg, 7: 8, 1998 ↩
-
Kogan, SJ: Reconstrucción genital feminizante para pseudohermafroditismo masculino. Eur J Pediatr, 152 Suplemento 2: S85, 1993 ↩
-
Gonzalez, R., Fernandes, ET: Genitoplastia de feminización en una etapa. J Urol, 143: 776, 1990 ↩
-
Duckett, JW, Baskin, LS: Genitoplastia para anomalías intersexuales. Eur J Pediatr, 152 Suppl 2: S80, 1993 ↩
-
Hutson, JM, Voigt, R., Luthra, M. y otros .: Clitoroplastia de reducción de la circunferencia: una nueva técnica: experiencia con 37 pacientes. Pediatric Surgery International, 6: 336, 1991 ↩
-
Roberts, JP, Hutson, JM: La reducción de la piel escrotalizada mejora la apariencia estética de la genitoplastia feminizante. Pediatr Surg Int, 12: 228, 1997 ↩
-
Donahoe, PK, Hendren, WH, 3º: reconstrucción perineal en bebés genitales ambiguos criados como hembras. Ann Surg, 200: 363, 1984 ↩
-
Passerini-Glazel, G .: Un nuevo procedimiento de 1 etapa para la clitorovaginoplastia en pseudohermafroditas femeninas severamente masculinizadas. J Urol, 142: 565, 1989. ↩ ↩2









