Anomalías del uraco en niños
J. Christopher Austin, MD
Oregon Health & Science University, Portland, OR, USA
Traducido y editado desde el original al español | Enlace a la versión en inglés
Dr. Juan Carlos Prietoa, Dr. Ricardo Antonio Arceo Olaizb
aMethodist Children's Hospital, San Antonio, Texas; Children's Hospital of San Antonio, San Antonio, Texas
bHospital Shriners para Niños Ciudad de México, México
Embriología y anatomía
El uraco es una estructura tubular que se encuentra permeable durante la gestación. Conecta el alantoides en el ombligo a la cúpula de la vejiga durante el desarrollo fetal 1. La luz normalmente se cierra alrededor de la duodécima semana de gestación y queda obliterado por completo. Después de esta obliteración, todo lo que típicamente queda es un cordón fibroso que se extiende desde la parte inferior del ombligo hasta el domo de la vejiga. El uraco es extraperitoneal y se observa fácilmente durante la visualización laparoscópica de la pelvis (Figura 1).
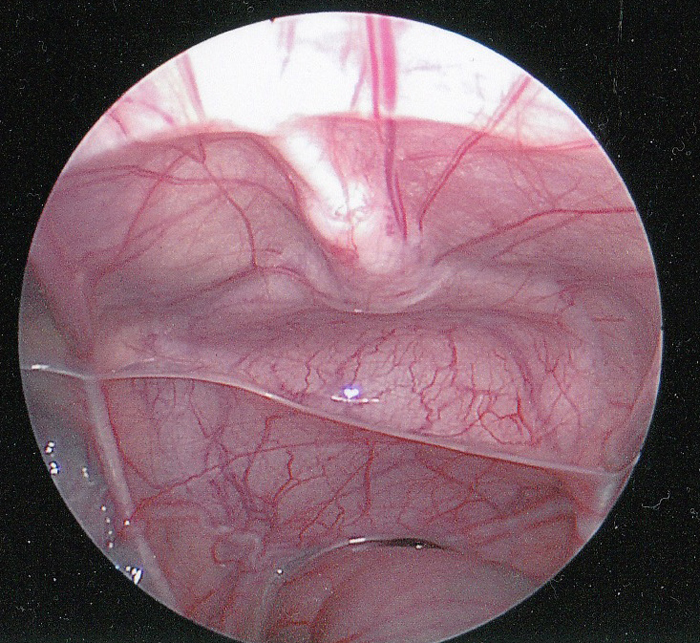
Figura 1 Vista laparoscópica intraperitoneal del uraco. El cordó n fibroso del uraco (ligamento umbilical medio) se muestra en la línea media que se extiende hasta el domo de la vejiga. El recto es inferior. El conducto deferente se puede ver extendiéndose lateralmente justo por encima del recto.
El uraco está cubierto por los pliegues del peritoneo para formar el ligamento umbilical medio. En raras ocasiones, el uraco puede tener huecos en el cordón fibroso o incluso una completa obliteración a lo largo de su trayecto desde el ombligo hasta el domo vesical. Es un punto de referencia quirúrgico importante para marcar el domo de la vejiga, asegurando así la posición correcta de una vesicostomía y se reseca en bloque junto con la vejiga durante la cistectomía radical. Hay opiniones contradictorias en cuanto a si la resección del uraco o no por afecciones no malignas debe incluir al menos una pequeña parte del domo vesical 2,3,4,5,6. En los casos en los que hay dudas sobre si la extensión de la lesión incluye dicho domo, es prudente incluir una pequeña porción del mismo con el espécimen de resección. La mayoría de las series de casos informan ambas técnicas, aunque la mayoría parece preferir incluir el domo sin diferencias claras en las complicaciones o los resultados.
Las manifestaciones clínicas más comunes en niños con anomalías del uraco son la secreción umbilical o una masa y / o dolor debido a una infección 3,4,6,7,8,9,10. La secreción umbilical puede ser clara, serosa, purulenta o sanguinolenta. Las anomalías en el uraco son una preocupación frecuente en los recién nacidos con drenaje umbilical que persiste más allá de unas pocas semanas. Además, dichas alteraciones pueden descubrirse incidentalmente durante los exámenes radiográficos en la evaluación de niños con infecciones del tracto urinario o hidronefrosis 7,8,10.
Clasificación de las anomalías del uraco
Las anomalías del uraco se deben a una falla en la obliteración completa de la luz durante la gestación 5. Su clasificación anatómica se basa en el grado en que la permeabilidad del uraco ha persistido. Las anomalías típicas del uraco se muestran en la Figura 2. Las posibilidades varían desde un uraco completamente permeable que permite que la orina drene libremente a través de la piel del ombligo hasta un pequeño tracto o seno con terminación ciega. Un quiste de uraco puede estar presente en cualquier lugar a lo largo del trayecto del mismo, pero se encuentra más comúnmente cerca del domo vesical. Un divertículo de uraco es una permeabilidad parcial del uraco que drena hacia el domo de la vejiga. Las anomalías mostradas en la figura 2 no son exclusivas, ya que puede haber combinaciones de los ejemplos mostrados.Por ejemplo, puede haber un seno uracal asociado con un quiste de uraco.

Figura 2 Diagrama que ilustra diferentes tipos de anomalías uracales. A - Obliteración normal de la luz del uraco. B - Quiste de uraco. C - uraco permeable. D - Seno de uraco. E - Divertículo de uraco.
La incidencia relativa de los diferentes tipos de anomalías de uraco de varias series clínicas se muestra en la Tabla 1.
Tabla 1. Resumen de los tipos e incidencia de anomalías de uraco que se presentan en niños.
| Autor | # Pacientes | Permeable | Seno | Quiste | Divertículo | |
|---|---|---|---|---|---|---|
| Ashley | 46 | 6 | 14 | 25 | 1 | |
| Copp | 29 | 3 | 17 | 7 | 2 | |
| Cilento | 45 | 7 | 22 | 16 | 0 | |
| Galati | 23 | 2 | 9 | 12 | 0 | |
| Mesrobiano | 21 | 2 | 9 | 9 | 1 | |
| Rico | 35 | 19 | 4 | 12 | 0 | |
| Yiee | 31 | 7 | 5 | 19 | 0 | |
| Total | 230 | 46 (20%) | 80 (35%) | 100 (43%) | 4 (2%) | |
El divertículo de uraco parece ser la anomalía más rara en todas las series, y algunas series recientes no reportan ninguno 2,3,4,[7-],8,9,10. Es interesante el informe de un solo caso de un uraco permeable que se cerró espontáneamente al dejar sonda vesical durante 2 semanas, persistiendo como un divertículo de uraco 11. Aunque solo es un caso, sugiere que puede haber una evolución dinámica de las anomalías que pueden cambiar con el tiempo si un bebé se trata de forma conservadora.
Presentación clínica
La mayoría de los remanentes de uraco durante la infancia presentarán, ya sea secreción de líquido por el ombligo, o una masa con evidencia de infección. Existe una distribución bimodal por edades con una edad promedio de 1 a 3 meses de edad para aquellos con un seno uracal o uraco permeable, versus una edad promedio de 3 años para aquellos que presentan un quiste de uraco 7. Las características del tipo de secreción sirven como pista para determinar la causa. La fuga persistente de líquido claro (probablemente orina) en un bebé es altamente sugestiva de un uraco permeable, mientras que el líquido turbio, seroso o sanguinolento es más indicativo de un seno o quiste de uraco. El diagnóstico diferencial de secreción umbilical también incluye onfalitis, remanente de conducto onfalomesentérico o un granuloma umbilical 4. Estas causas no uracales deben considerarse durante la evaluación de pacientes con secreción umbilical.
Tabla 2. Presentación de síntomas en niños con anomalías de uraco.
| Autor | # Pacientes | Secreción | Dolor | Masa Infección | Asintomático | Otro | |
|---|---|---|---|---|---|---|---|
| Cilento | 45 | 19 | 10 | 15 | 0 | 1 | |
| Copp | 29 | 13 | 0 | 10 | 5 | 1 | |
| Galati | 23 | 15 | 1 | 5 | 2 | 0 | |
| McCollum | 26 | 7 | 3 | 11 | 0 | 5 | |
| Mesrobiano | 21 | 12 | 4 | 4 | 0 | 1 | |
| Yiee | 37 | 20 | 4 | 8 | 2 | 3 | |
| _Total _ | 181 | 86 (48%) | 22 (12%) | 53 (29%) | 9 (5%) | 11 (6%) | |
El examen físico también puede ser útil. Un uraco permeable o un seno uracal puede aparecer como un hoyuelo o hendidura en la base del ombligo (Figuras 3 y 4).
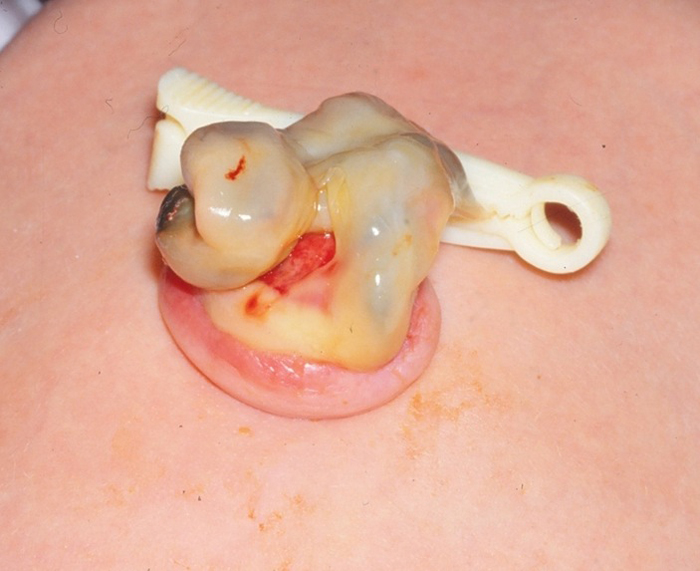
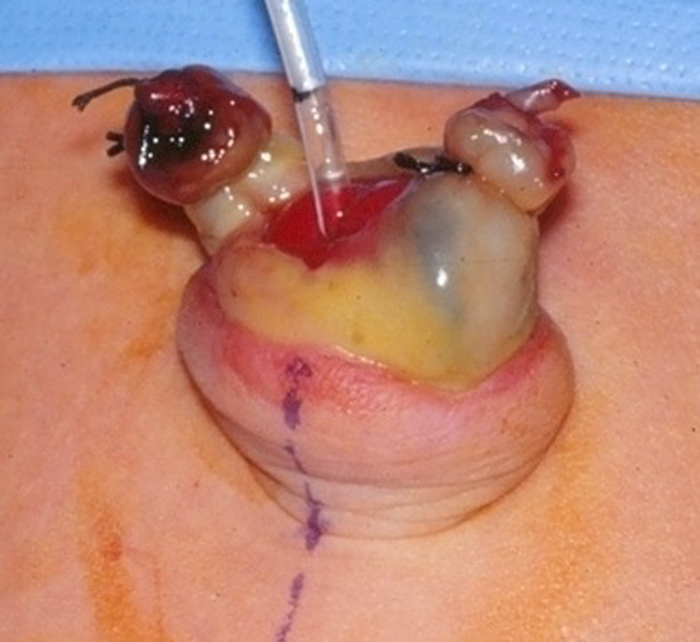
Figura 3 y 4 Uraco permeable en un recién nacido. 3) Demuestra la apariencia roja y carnosa del extremo umbilical de un uraco permeable. 4) La piel del ombligo se ha evertido y se ha pasado una pequeña sonda de alimentación a través del uraco permeable hacia la vejiga.
Algunas anomalías del uraco se descubren de manera incidental durante la evaluación radiográfica de rutina en otros trastornos, como infecciones del tracto urinario o hidronefrosis prenatal. Es probable que se observen quistes de uraco durante la ecografía de la vejiga (Figura 5).
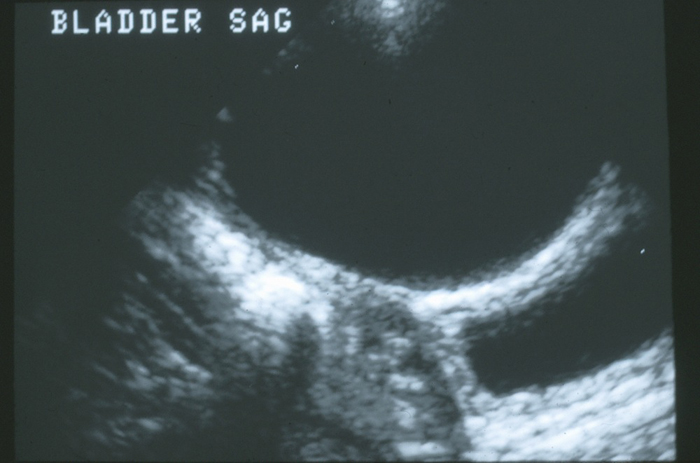
Figura 5 Vista sagital del domo de la vejiga en la línea media. Hay un gran quiste de uraco anecoico anterior a la pared de la vejiga.
Carcinoma deuraco
Debido a que el carcinoma de uraco no es una enfermedad que se presente en niños o adolescentes, el tratamiento de este trastorno no se incluirá en este capítulo [9, 12]. Como se discutirá en la sección sobre manejo, se desconoce cuál es el riesgo de que una anomalía de uraco asintomática desarrolle carcinoma y, por lo tanto, el valor de la escisión profiláctica de dicha anomalía es de valor desconocido. Los hallazgos más preocupantes en una anomalía de uraco que sugieren carcinoma son el tamaño superior a 4 cm y la edad superior a 55 años. Las calcificaciones son una característica que es más común en el carcinoma [9,12]. Se desconoce si las calcificaciones en un remanente benigno asintomático de uraco predisponen a desarrollar carcinoma, pero parece prudente resecar las lesiones con calcificaciones, dado que las calcificaciones pueden estar asociadas con la inflamación crónica, la cual a su vez se relaciona con carcinogénesis.
Evaluación radiológica
Los estudios de imagen están orientados por los síntomas de presentación y el grado de sospecha clínica 4,7. Un uraco permeable que permite que la orina drene libremente a través del ombligo, se puede visualizar mediante un cistouretrograma miccional (CUGM) o sinograma, con un alto índice de sensibilidad. El autor prefiere evaluar a los niños con un CUGM, ya que no solo identificará el uraco permeable, sino que también proporcionará una evaluación anatómica de la vejiga, evaluará la obstrucción de la salida de la vejiga y la presencia de reflujo vesicoureteral (Figura 6).
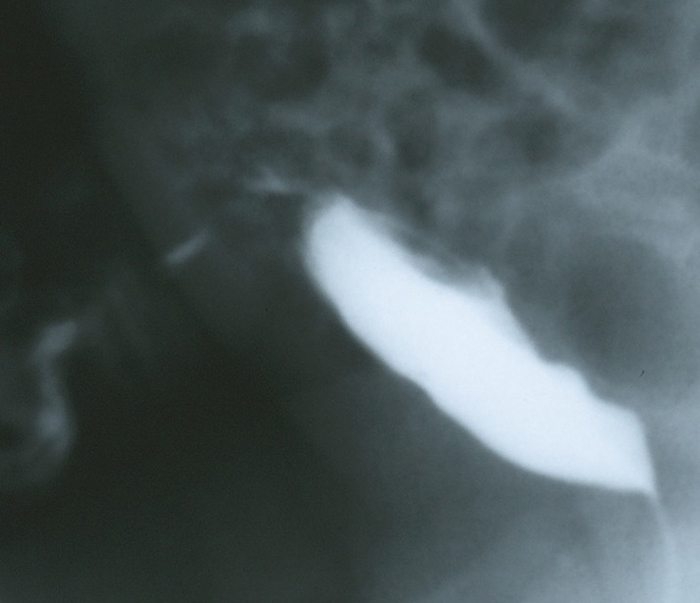
Figura 6 Vista lateral de llenado de un CUGM en un bebé con gran cantidad de líquido claro que drena por el ombligo. La imagen muestra un contraste que drena por la pared abdominal anterior desde el domo de la vejiga a través del uraco permeable.
Aunque la posibilidad de encontrar otras anomalías asociadas del tracto genitourinario es baja en pacientes con un uraco permeable, la evaluación también debe incluir una ecografía renal para asegurar la ausencia de hidronefrosis u otras anomalías renales congénitas 4,7,10,12. La incidencia de anomalías renales concomitantes ha variado ampliamente en las series publicadas, pero dada la falta de morbilidad y riesgo con la ecografía, es prudente incluir imágenes de los riñones como parte del estudio.
Un quiste de uraco con un tamaño superior a unos pocos milímetros se puede visualizar fácilmente mediante ultrasonido. Pueden detectarse incidentalmente en niños asintomáticos cuando se examina la vejiga durante la evaluación ecográfica de rutina, como después de una infección del tracto urinario. Si hay una distancia significativa desde la vejiga, es posible que el quiste no se vea fácilmente y, por lo tanto, es importante notificar al ultrasonografista las sospechas clínicas al seguir o evaluar una posible anomalía de uraco, para que la pared abdominal de la línea media pueda examinarse detenidamente, además del domo de la vejiga. Los quistes de uraco infectados aparecen como grandes masas heterogéneas con colecciones líquidas complejas (Figuras 7 y 8).
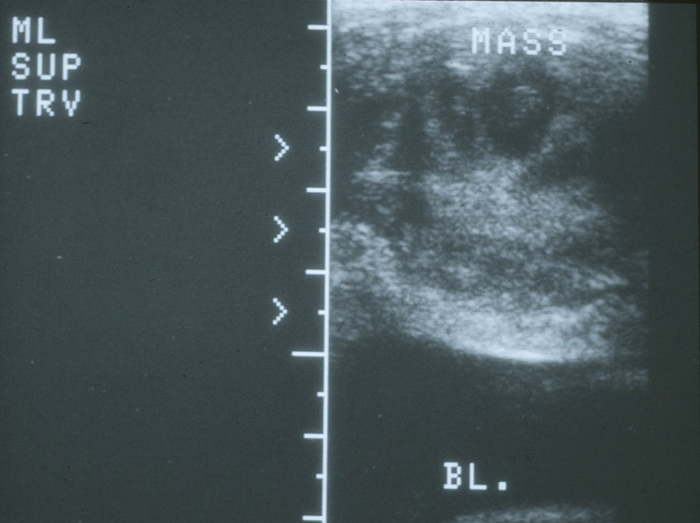
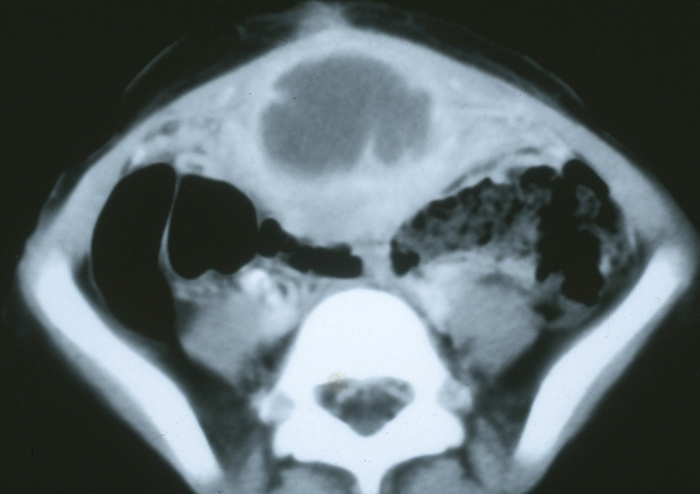
Figuras 7 y 8 Quiste de uraco infectado. 7) Vista transversal del domo vesical en la línea media que demuestra una masa ecogénica heterogénea sobre la vejiga. 8) Tomografía computarizada que muestra la masa de la línea media con una densidad del líquido central consistente con un absceso y estriación inflamatoria de la pared abdominal anterior adyacente.
Figuras 7 y 8 Quiste de uraco infectado. 7) Vista transversal del domo vesical en la línea media que demuestra una masa ecogénica heterogénea sobre la vejiga. 8) Tomografía computarizada que muestra la masa de la línea media con una densidad del líquido central consistente con un absceso y estriación inflamatoria de la pared abdominal anterior adyacente.
Las lesiones pueden ser de varios centímetros de diámetro y, en ocasiones, pueden extenderse más allá del espacio preperitoneal y perforar la cavidad peritoneal 13,14. En los casos en los que el diagnóstico es incierto, una tomografía computarizada (TC) puede proporcionar excelentes detalles anatómicos (Figuras 9, 10, y 11).
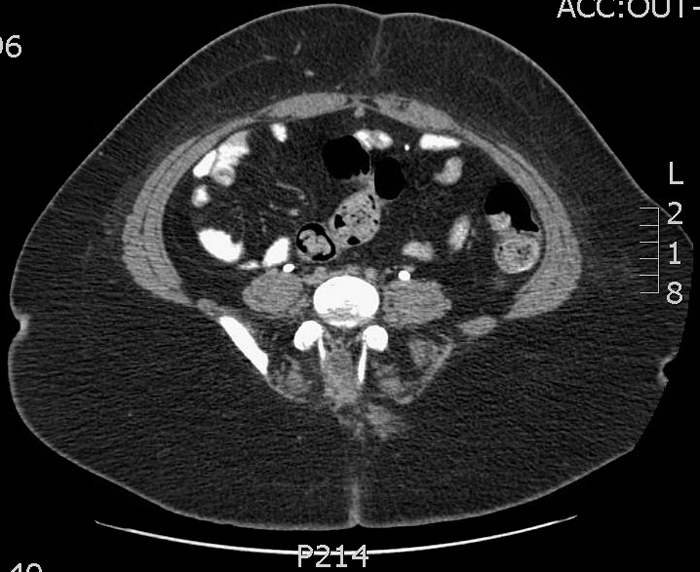
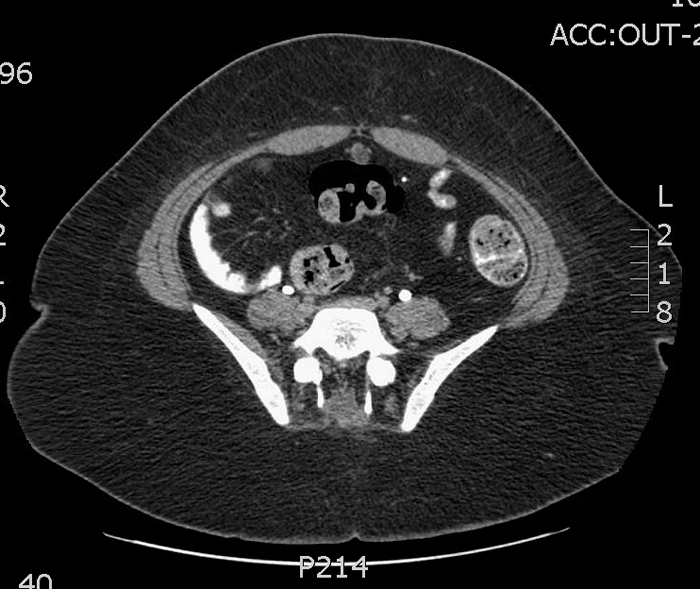
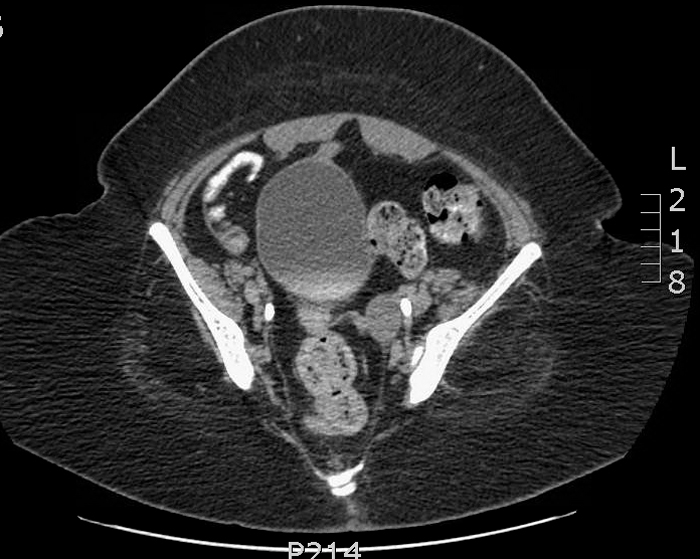
Figuras 9, 10, y 11 Tomografía computarizada en un paciente con secreción umbilical sanguinolenta recurrente. 9) La imagen justo inferior al ombligo muestra un uraco de apariencia normal (cordón fibroso) justo por debajo a los músculos rectos en la línea media. 10) Se muestra un quiste de uraco más inferior. 11) Se demuestra la proximidad de la extensión inferior del quiste y el domo vesical.
Dada la práctica actual para minimizar la exposición a la radiación en los niños a un nivel lo más bajo posible, la TC no debe considerarse un componente integral del abordaje de rutina. Sin embargo, en los casos en los que existe un alto grado de sospecha clínica con un ultrasonido negativo (como secreción umbilical sanguinolenta recurrente), una TC puede ser útil para obtener imágenes del uraco y mostrar lesiones que el ultrasonido puede pasar por alto.
Tratamiento
En general, los remanentes de uraco que causan síntomas deben tratarse con escisión quirúrgica. Esto debe incluir la extirpación completa del uraco desde el ombligo hasta el domo vesical (Figuras 12 y 13).
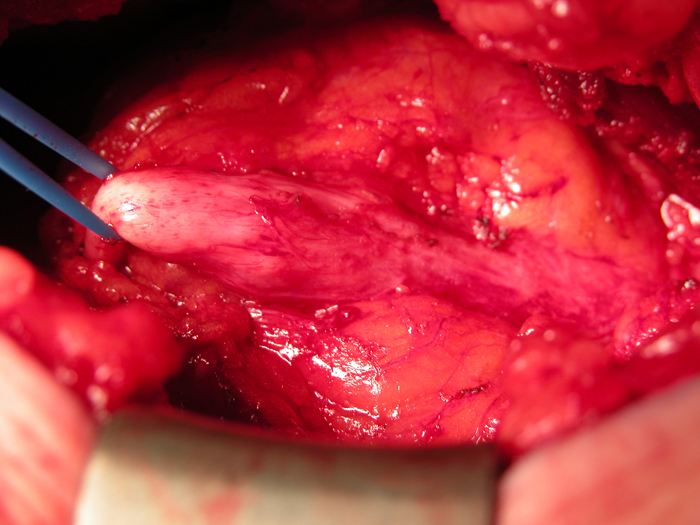
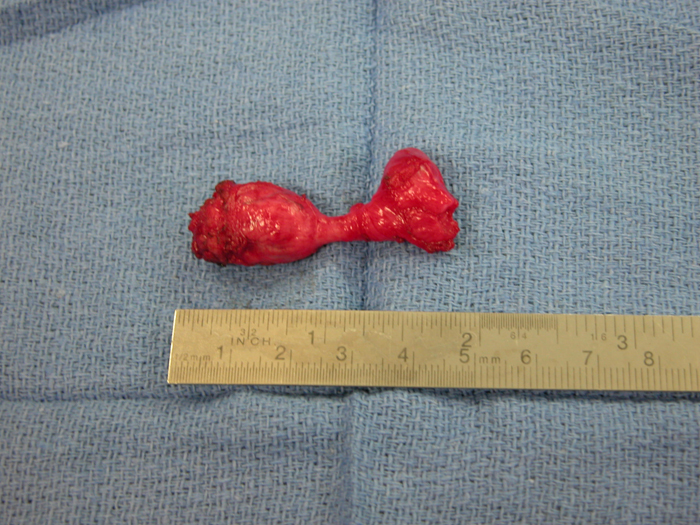
Figuras 12 y 13 Escisión abierta de quiste de uraco. 12) Vista intraoperatoria de la escisión de un quiste de uraco mediante una incisión infraumbilical en la línea media. El quiste está en el centro con la unión de la vejiga a la derecha y el cordón fibroso que se extiende hacia el ombligo hacia la izquierda. 13) El espécimen (quiste) después de la escisión con el pequeño ribete de vejiga (extremo derecho del espécimen).
Existe controversia sobre si se debe incluir el domo de la vejiga, ya que el cordón fibroso o el quiste se pueden extirpar sin entrar en la vejiga (sin embargo, esto no es posible en un uraco permeable, el cual extirparse por completo) [2 6]. Los quistes de uraco infectados presentan otro dilema, ya que el marcado agrandamiento del quiste debido a la infección y la inflamación circundante dificultan la escisión simple y puede aumentar el riesgo de complicaciones. Se puede abordar el quiste infectado, ya sea en un solo procedimientos o por etapas. 2,3,15,16,17. Los beneficios y riesgos relativos de los dos abordajes se tratarán con más detalle a continuación.
La escisión quirúrgica del remanente de uraco es curativa y no hay secuelas funcionales por el hecho de resecarlo, ya que es un remanente vestigial. El principal dilema quirúrgico se produce en pacientes que presentan una lesión asintomática que se descubre de forma incidental durante un estudio de imagen. El análisis patológico de los restos de uraco extirpado mostró epitelio persistente en el remanente 10. Pueden presentarse múltiples tipos histológicos, incluidos transicionales, escamosos, metaplásicos y gastrointestinales. El tipo transicional es el más común. La presencia de mucosa gastrointestinal es un hallazgo raro. No se encontró epitelio en solo una minoría de muestras y se distribuía a lo largo de los diversos tipos de remanentes. Por lo tanto, el tipo de anomalía del uraco no fue predictor de la presencia o ausencia de epitelio intraluminal. Si la lesión fue sintomática o asintomática tampoco fue predictor. Por lo tanto, todos los tipos de anomalías del uraco están en riesgo de contener epitelio no regresivo. El potencial maligno del epitelio persistente en el uraco es desconocido, pero se considera una preocupación. Este hallazgo favorece la escisión de los remanentes debido al riesgo potencial de formación de tumores en un futuro.
Tratamiento conservador
Para un cirujano puede ser una decisión más difícil no operar. Esto es cierto para las anomalías asintomáticas del uraco. Los niños tienen una larga expectativa de vida y la falta de información confiable sobre el riesgo a largo plazo de infección o malignidad, que son las dos morbilidades más importantes a largo plazo de dichas alteraciones, es una preocupación cuando se decide seguir un abordaje conservador. La lesión más común que se encuentra de manera incidental es un quiste de uraco 7,8. La edad del paciente, el riesgo de anestesia debido a cualquier comorbilidad y las circunstancias en las que se descubrió el quiste deben considerarse. Si el paciente está siendo evaluado para una infección del tracto urinario y se encuentra que tiene reflujo vesicoureteral, puede ser prudente esperar hasta que uno haya decidido si el reflujo necesitará corrección quirúrgica, ya que el quiste de uraco se puede extirpar fácilmente durante la cirugía de reimplante ureteral. Publicaciones recientes han defendido un enfoque conservador 8,11. Se han documentado informes de cierre espontáneo de urracas permeables y regresión espontánea de quistes de uraco en niños menores de 6 meses de edad. Esto indica que todos los niños menores de 6 meses de edad con una anomalía asintomática de uraco deben tratarse inicialmente de manera conservadora, con escisión quirúrgica reservada para aquellos en quienes las lesiones persisten a medida que son seguidas durante los próximos 6 a 12 meses. No se han reportado morbilidades con la observación a corto plazo para el seguimiento clínico o radiológico, pero la mayoría de los pacientes de estas series fueron seguidos durante menos de 1 año. Si uno toma un abordaje conservador, es importante educar a los padres en cuanto a los signos y síntomas de un uraco infectado, así como prevenirlos que una vez que el remanente de uraco se infecte, un simple procedimiento ambulatorio se convierte en algo más complejo, posiblemente requiriendo cirugía en etapas.
Manejo de los quistes de uraco infectados
El manejo inicial debe centrarse en controlar la infección. Para ayudar a dirigir la terapia con antibióticos, se debe obtener cultivo de orina y cultivo de cualquier secreción de la herida, si ésta está presente. Si el paciente tiene fiebre, se deben obtener hemocultivos. Se deben iniciar antibióticos de amplio espectro. El organismo más común cultivado a partir de quistes de uraco infectados es Staphalococcus aureus (Tabla 3).
Tabla 3. Especies microbianas cultivadas a partir de remanentes de uraco infectados.
| Autor | # Pacientes | S. aureus | Strep sp | Otros * | |
|---|---|---|---|---|---|
| Ashley | 9 | 6 | 1 | 2 | |
| Galati | 5 | 5 | 0 | 0 | |
| McCollum | 9 | 6 | 1 | 2 | |
| Minevich | 9 | 9 | 0 | 0 | |
| Hombre nuevo | 5 | 3 | 0 | 2 | |
| Total | 37 | 29 (79%) | 2 (5%) | 6 (16%) | |
* E Coli, Citrobacter, Enterococcus y Proteus.
Los antibióticos deben elegirse teniendo en cuenta los patrones de resistencia locales de esos organismos. Si el paciente está estable, afebril, sin datos de sepsis o signos de irritación peritoneal, celulitis diseminada o signos de fascitis, se puede considerar el tratamiento inicial con antibióticos solos.
Existen diferentes abordajes para el tratamiento quirúrgico del quiste de uraco infectado. Básicamente, se trata de una escisión quirúrgica completa inicial vs. drenaje (o terapia inicial con antibióticos solamente) y una escisión posterior una vez que la respuesta inflamatoria inicial de la infección aguda haya disminuido. El tratamiento de elección del autor ha sido típicamente el enfoque por etapas. Desde hace mucho tiempo, el estándar quirúrgico de resecar el uraco es de suma importancia; y no solamente drenarlo, para así prevenir infecciones recurrentes.
En la escisión del uraco infectado en un solo tiempo quirúrgico, los márgenes de la resección serán más grandes y darán como resultado un defecto mayor en los tejidos blandos y la extensión de la inflamación puede extenderse por vía intraperitoneal, lo que pone en riesgo las vísceras abdominales. Existe un riesgo pequeño pero significativo de fístula enterocutánea y una tasa más alta de complicaciones de la herida después de la escisión primaria de un quiste de uraco infectado en comparación con una cirugía en etapas 6,15,17.
En el abordaje por etapas, si el niño es altamente sintomático o no responde a la terapia con antibióticos, el absceso se puede drenar por vía percutánea o mediante una incisión abierta. No en todas las ocasiones es completamente efectivo, ya que el drenaje percutáneo (que puede colocarse con ultrasonido o guiado por TC) puede drenar de forma incompleta una colección de líquido multiloculado. Un drenaje tipo cola de cochino colocado percutáneamente ayudará a guiar la resección secundaria de la pared del quiste durante el segundo procedimiento. Si no se deja algún tipo de drenaje, a menudo es difícil identificar la pared del quiste en el tejido cicatricial fibrótico que permanece después del drenaje inicial durante la exploración en la segunda etapa. El drenaje abierto puede drenar de manera más efectiva las colecciones multiloculadas, pero a menos que se deje un drenaje a través de la incisión, nuevamente será difícil identificar las paredes del quiste después de que la inflamación haya disminuido. Después de que la inflamación haya cedido, la masa ya incrementará su tamaño (la mayoría de los quistes de uraco infectados parecen muy grandes [3-6 cm] cuando están infectados) y la pared del quiste puede ser difícil de localizar dentro de la fibrosis tisular local y la cicatrización secundaria a la infección y cirugía previas. Existe controversia sobre si es necesaria una cirugía adicional después de la incisión inicial y el drenaje, pero parece prudente intentar la resección completa del uraco después de una infección significativa.
Escisión laparoscópica del uraco
En esta era de la cirugía mínimamente invasiva, han surgido múltiples informes de resección de remanentes de uraco en niños, ya sea mediante laparoscopia o, más recientemente, asistida con robot 18,19,20. También se ha informado la cirugía laparoscópica mediante un solo puerto 21. La principal ventaja de la tecnología robótica es durante el cierre del domo de la vejiga para los cirujanos que no cuentan con tanta destreza al realizar sutura laparoscópica 20. La visualización de la vejiga es excelente con un abordaje laparoscópico, pero puede ser más demandante a nivel del ombligo si los puertos no están colocados con cuidado. El uraco debe resecarse desde la base del ombligo hasta el domo de la vejiga. Nuevamente, existe controversia sobre si la resección completa requiere o no la extirpación del domo vesical 18,19. Si existe alguna duda sobre la extensión de la lesión que se extirpa, entonces uno debe optar por una resección más completa. La colocación del puerto es una consideración importante 19. Dado que el uraco se origina en el ombligo, esto no se puede utilizar como un sitio de puerto. El sitio más común para la cámara es supraumbilical (generalmente 1-2 cm). Esto proporciona suficiente espacio de trabajo para visualizar la disección desde el ombligo hasta el domo de la vejiga. Los puertos de trabajo deben colocarse lateralmente en ambos lados, generalmente a nivel del ombligo. Deben ser lo suficientemente laterales para dar la movilidad necesaria para iniciar la disección en el ombligo. Alternativamente, los puertos de trabajo laterales y la colocación de la cámara (en el lado derecho o izquierdo del abdomen) ofrecen una visualización lateral del uraco y mantienen todos los puertos infraumbilicales en su ubicación. La configuración del puerto lateral hace que la sutura del cierre de la vejiga sea más difícil debido al ángulo. Las técnicas recomendadas para el cierre del domo vesical o la unión del uraco a la vejiga han incluido el uso de la grapadora GIA, sutura directa con sutura absorbible y clips. Aunque no hay reportes de formación de cálculos a nivel del domo que estén asociados al uso de grapas, parece prudente utilizar una técnica de cierre que no deje clips o grapas metálicas permanentes en la pared de la vejiga.
Escisión abierta del uraco
En bebés y niños pequeños, la resección completa del uraco se puede lograr fácilmente a través de una pequeña incisión. Puede ser orientado en una línea media transversal o vertical. Para los bebés, una pequeña incisión de 1-1,5 cm a la mitad entre el pubis y el ombligo dará acceso al uraco y permitirá la resección completa desde el ombligo hasta el domo de la vejiga con una excelente exposición para el cierre. Esta pequeña incisión es comparable al tamaño de incisión necesario para el puerto de la cámara de 12 mm del robot quirúrgico y mantiene el procedimiento completamente extraperitoneal, eliminando las posibles complicaciones intraabdominales. En niños o adolescentes mayores u obesos, es prudente hacer una incisión vertical en la línea media. Si hay problemas con la exposición, la incisión se puede extender hacia el ombligo o hacia la vejiga para facilitar la remoción completa del uraco en estos pacientes. Las tasas de complicaciones para la escisión simple son muy bajas y la cirugía puede realizarse de manera ambulatoria o con una corta estancia en el hospital si se deja un catéter en su lugar. Las fugas de orina o las complicaciones de la herida se asocian con mayor frecuencia a la resección de los quistes infectados en una etapa y no con la escisión simple 6,15.
Resumen
Las anomalías del uraco pueden presentarse en diversas formas. Por lo general, se presentan con secreción umbilical o infección (masa suprapúbica). Se pueden encontrar anomalías asintomáticas en estudios de ultrasonido o CUGM que evalúan a los niños para detectar infecciones del tracto urinario. Las anomalías sintomáticas del uraco deben ser extirpadas quirúrgicamente. Existe controversia sobre si las anomalías asintomáticas necesitan tratamiento o no. Los estudios histológicos muestran que la mayoría de las anomalías de uraco tienen algún epitelio persistente. El verdadero riesgo de infección o degeneración maligna de éstos no se conoce. La escisión simple debe evitar que se desarrollen estas afecciones, y dada la naturaleza relativamente benigna de la resección versus el tratamiento de una anomalía infectada y el estadio avanzado habitual del carcinoma de uraco en el momento de la presentación y el mal pronóstico, el tratamiento temprano parece una opción lógica.
Referencias
-
Parque JM. Desarrollo normal del sistema urogenital. En Campbell- Urología Walsh. Wein, Kavossi, Novick, Partin, Peters eds. 2007. Elsevier, Filadelfia. ↩
-
Rich RH, Hardy BE, Filler RM. Cirugía para anomalías del uraco. J Pediatr Surg 1983: 4: 370-372. ↩ ↩2 ↩3
-
Mesrobian HG, Zacharias A, Balcom AH, Cohen RD. Diez años de experiencia con anomalías aisladas de urachal en niños. J Urol 1997; 158: 1316-1318. ↩ ↩2 ↩3 ↩4
-
Cilento BG, Bauer SB, Retik AB, et al. Anomalías de Urachal: definiendo la mejor modalidad diagnóstica. Urol 1998; 52: 120-122. ↩ ↩2 ↩3 ↩4 ↩5 ↩6
-
MacNeily AE, Koleilat N, Kirulata HG, Homsey YL. Los accesos de Urachal: manifestaciones proteicas, su reconocimiento y manejo. Urol 1992: 40: 530-535. ↩ ↩2
-
McCollum MO, MacNeily AE, Blair GK. Implicaciones quirúrgicas de los remanentes de uraco: presentación y manejo. J Pediatr Surg 2003; 38: 798-803. ↩ ↩2 ↩3 ↩4
-
Yiee JH, Garcia N, Baker LA, et al. Un algoritmo de diagnóstico para las anomalías uracales. J Pediatr Urol 2007; 3: 500-504. ↩ ↩2 ↩3 ↩4 ↩5 ↩6
-
Galati VG, Donovan B, Ramji F, et al. Manejo de restos de uraco en la primera infancia. J Urol 2008; 180: 1824-1827. ↩ ↩2 ↩3 ↩4 ↩5
-
Ashey RA, Inman BA, Routh JC, et al. Anomalías de Urachal: un estudio longitudinal de los restos de urachal en niños y adultos. J Urol 2007; 178: 1615-1618. ↩ ↩2
-
Copp HL, Wong IY, Krishnan C, Malhotra S, Kennedy WA. Presentación clínica y patología del remanente de uraco: implicaciones para el tratamiento. J Urol 2009; 182: 1921-1924. ↩ ↩2 ↩3 ↩4 ↩5
-
Cuda SP, Vanasupa BP, Sutherland RS. Manejo no operatorio de una patente de uraco. Urol 2005; 66: 1320 e7-e9. ↩ ↩2
-
Gonzales R, De Fillipo R, Jednak R, Spencer-Barthold J. Atresia uretral: resultado a largo plazo en 6 niños que sobrevivieron al período neonatal. J Urol 2001; 165: 2241-2244. ↩
-
Lewis JB, Morse JW, Eyolfson MF, Schwartz SL. Rotura espontánea de un divertículo vesicourachal que se manifiesta como dolor abdominal agudo. Acad Emerg Med 1996; 3: 1140-1143. ↩
-
Ogebeven JO, Jaffe DM, Langer JC. Rotura intraperitoneal de un quiste de uraco infectado: una causa rara de peritonitis en niños. Pediat Emerg Med 1996; 12: 41-43. ↩
-
Minevich E, Wacksman J, Lewis AG, y col. El quiste de uraco infectado: escisión primaria frente a un abordaje por etapas. J Urol 1997; 157: 1869-1872. ↩ ↩2 ↩3
-
Newman, BM, Karp MP, Jewett TC, Cooney DR. Avances en el manejo de los quistes de uraco infectados. J Pediatr Surg 1986; 12: 1051-1054. ↩
-
Yoo KH, Lee SL, Chang S. Tratamiento de quistes de uraco infectados. Yonsei Med J 2006; 47: 423-427. ↩ ↩2
-
Stone NN, Garden RJ, Weber H. Escisión laparoscópica de un quiste de uraco. Urol 1995; 45: 161-164. ↩ ↩2
-
Corte de CWM, Hindley RG, Poulsen J. Manejo laparoscópico de remanentes de uracal complicados. BJU Int 2005; 96: 1417-1421. ↩ ↩2 ↩3
-
Yamzon J, Kokorowski P, De Fillipp RE, Chang AY, Hardy BE, Koh CJ. Escisión laparoscópica pediátrica asistida por robot de quiste de uraco y manguito vesical. J Endourol 2008; 22: 2385-2388. ↩ ↩2
-
Patrzyk M, Glitsch A, Schreiber A, von Berstorff W, Heidecke CD. Cirugía laparscópica de incisión única como opción para la resección laparoscópica de una fístula de uraco: primera descripción de la técnica quirúrgica. Surg Endosc 2010: 24: 2339-2342. ↩









