Fisiología renal
Danielle E. Soranno, MD
Children’s Hospital Colorado, Aurora, CO, USA
Traducido y editado desde el original al español | Enlace a la versión en inglés
Dra Maria Santos, Dra Carolina Acuña
Hospital Padre Hurtado, Santiago Chile
Visión general de la función renal
los riñones desempeñan un papel fundamental en la salud y el desarrollo de los niños. El nefron es la unidad funcional del riñón, ya que cada riñón contiene aproximadamente 500,000-1,000,000 nefrones. Acumulativamente, los procesos básicos del nefron son 1) filtración, 2) reabsorción y 3) secreción.
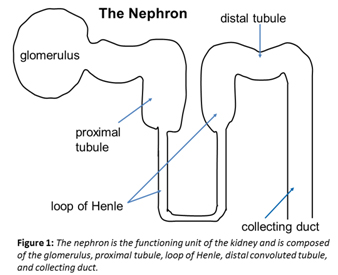
Figura 1
Cada nefron se divide en: 1) el glomérulo, 2) el túbulo proximal, 3) el asa de Henle, 4) el túbulo contorneado distal y 5) los conductos colectores (Figura 1). Los glomérulos ('filtros') tienen selectividad de carga y tamaño y filtran el plasma a través de la capa basal endotelial (capilar), glomerular y epitelial (podocito). El túbulo proximal es donde se produce aproximadamente el 85% de la reabsorción, que incluye sodio, agua, aminoácidos y glucosa. El asa de Henle permite la dilución y posterior concentración de orina a través del multiplicador de contracorriente. El túbulo contorneado distal contiene la mácula densa, que es fundamental para la retroalimentación yuxtaglomerular con la posterior autorregulación del flujo sanguíneo renal. La autorregulación permite una tasa de filtración glomerular (TFG) bastante constante en circunstancias fisiológicas normales. Finalmente, los conductos colectores responden a la hormona antidiurética (ADH), que permite la concentración de la orina como también de la aldosterona que regula la secreción de potasio.
Resumen de funciones principales de los riñones:
- Filtración de los desechos de nitrógeno
- Control de volumen y presión arterial
- Balance electrolítico
- Regulación de pH
- Conversión de vitamina D
- Producción de eritropoyetina
Más allá de la filtración, los riñones también controlan el volumen y la presión sanguínea (tanto a través de la respuesta a la hormona antidiurética como por el sistema de renina angiotensina aldosterona), regulan el equilibrio de electrolitos, ayudan a regular el pH del suero, convierten la 25-hidroxi vitamina D inactiva en activa 1- 25-dihydroxyvitamin D y producen eritropoyetina.
Evaluación de la función renal
A pesar de la complejidad de la filtración, la reabsorción y la secreción a lo largo del nefron, la función del nefron se simplifica en 1) filtración (glomérulos) y 2) función tubular.
1. Filtración
La tasa de filtración glomerular (TFG) es la velocidad a la que el plasma se filtra de forma acumulativa a través de los nefrones. Después de la filtración, la mayor parte de la carga filtrada se reabsorbe a lo largo del nefron. En pediatría, la ecuación de Schwartz se usa más comúnmente para estimar la TFG en niños.1 La ecuación de Schwartz (Figura 2) se basa en la creatinina sérica y en la altura del niño. Mientras que un TFG normal en adultos es de ~ 120 mL / min / 1.73m2, en pediatría un TFG normal varía según la edad del niño. Por lo general, la TFG inicial de un recién nacido de término es de ~ 30 mL / min / 1.73m2, mientras que el TFG inicial de un neonato prematuro puede ser incluso menor de 15 mL / min / 1.73m2. Independientemente de la edad gestacional, la TFG se duplica dentro de las 2 semanas de edad debido a la disminución de la resistencia vascular con un aumento resultante en el flujo sanguíneo renal y la perfusión. Luego, la TFG continúa aumentando (corregida por el área de la superficie corporal) y alcanza las normas de los adultos aproximadamente a los 19 meses de edad.

Figura 2
2. Función tubular
La función tubular se puede evaluar mediante el equilibrio de electrolitos, así como la capacidad de concentrar y diluir la orina. Las tubulopatías a menudo se diagnostican a través de la interpretación de alteraciones electrolíticas.2 Por ejemplo, la eliminación tubular de sodio, fósforo, potasio, aminoácidos y glucosa debería hacer sospechar un síndrome de Fanconi. El síndrome de Fanconi ocurre cuando hay un defecto global en la función tubular proximal con pérdidas urinarias resultantes de la carga filtrada que normalmente se reabsorbería.3 Los niños con síndrome de Fanconi suelen presentarse con retraso en el desarrollo.
Como se indicó anteriormente, la concentración urinaria se produce en los conductos colectores en presencia y respuesta renal a la hormona antidiurética (ADH). El gradiente de concentración que permite concentrar la orina se establece en el asa de Henle, que primero diluye la orina. La orina se puede diluir a ~ 50 mOsm/kg y concentrarse a ~ 1200 mOsm/kg. La capacidad de concentración total tarda varios meses en desarrollarse y un recién nacido de término puede concentrar su orina a ~ 500 mOsm/kg. Este defecto de concentración de la infancia es el resultado de un multiplicador de contracorriente inmaduro, así como de una relativa insensibilidad tisular a la ADH.4
En general, si los electrolitos plasmáticos (sodio, potasio, fósforo, calcio, bicarbonato) están dentro de los límites normales, el análisis de orina indica que el niño puede concentrar o diluir su orina y por lo tanto no hay pérdida tubular de glucosa o aminoácidos / proteínas. Por lo que se puede interpretar como una función renal normal.
Insuficiencia renal aguda
La insuficiencia renal aguda (IRA) se refiere a una disminución repentina de la tasa de filtración glomerular. La IRA es generalmente reversible, sin embargo, podría conducir a una enfermedad renal crónica (ERC). Hay varias clasificaciones para IRA.5 como los criterios p-RIFLE, que estratifican la IRA en niños entre "Riesgo, lesión, falla, pérdida y etapa final". Los criterios RIFLE se basan en la producción de orina y el aumento de la creatinina sérica.6
En el contexto de IRA, es importante entender que un aumento en la creatinina aparece típicamente solo después de que ha comenzado una disfunción renal significativa y con frecuencia varios días después del ataque inicial.
Para determinar la etiología de la IRA se deben evaluar los procesos prerrenales, renal u obstructivos. La obstrucción se puede descartar mediante imágenes, por lo general a través de ultrasonido renal y vesical. Las etiología prerrenal e intrínseca de la lesión renal se tratarán a continuación:
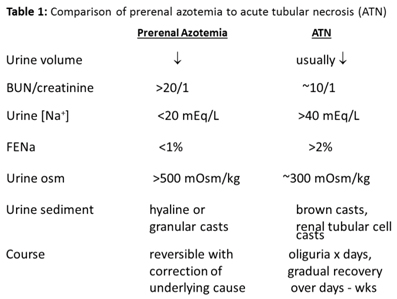
La azotemia prerrenal se refiere a una disminución de la TFG secundaria a una mala perfusión renal, a menudo en el contexto de deshidratación o pérdida de volumen. Los pacientes prerrenales a menudo presentaran oliguria (producción de orina <0,5 ml / kg / h en niños) y mostrarán signos y síntomas de deshidratación (taquicardia, mucosas secas, hipotensión, aumento de turgencia de piel). La evaluación de la fracción excretada de sodio urinaria (FENa) será muy baja (<1%) (Tabla 1), lo que indica que los túbulos renales están reabsorbiendo adecuadamente el sodio. El nitrógeno ureico en sangre (BUN) suele estar elevado debido a un aumento en la reabsorción de sodio en el túbulo proximal que resulta en una reabsorción pasiva de agua y nitrógeno ureico. Por lo tanto, la proporción de BUN en suero del paciente con respecto a la creatinina será elevada en la azotemia prerrenal. El tratamiento de la azotemia prerrenal es la reposición de volumen intravascular, por lo general a través de bolos salinos normales. Después de alcanzar la euvolemia, es importante no continuar el bolo con líquidos excesivos, ya que la azotemia prerrenal puede conducir a una necrosis tubular aguda (explicada más abajo) si la lesión es de larga duración y, en tales casos, los pacientes caen en anuria. En este caso, el exceso de reanimación con líquidos puede provocar hipervolemia y una consecuente hipertensión arterial.
La insuficiencia renal intrínseca se refiere a una IRA que no es secundaria a causas prerrenales u obstructivas. Las etiologías son diversas:
- Vascular
- Glomerulonefritis
- Necrosis tubular aguda (NTA)
- Nefritis intersticial aguda (NIA)
Vascular
- Las causas vasculares de la IRA son comunes e incluyen cualquier alteración en el flujo sanguíneo al riñón, generalmente secundario a medicamentos:
- AINEs, ciclosporina, tacrolimus: producen vasoconstricción de arteriolas aferentes. Por lo tanto están contraindicados en cualquier paciente deshidratado. ver Figura 3.7
- IECA, ARA II: producen vasodilatación de arteriolas eferentes.8
Las microangiopatías trombóticas (MAT), como el síndrome urémico hemolítico (SHU) también se pueden clasificar como una causa vascular de IRA. En la MAT, se forman trombos ricos en plaquetas en los capilares de los glomérulos, lo que conduce a una disminución de la FVG.
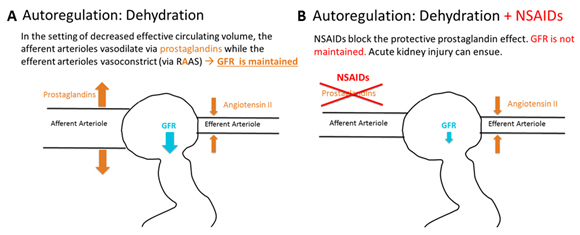
Figura 3
Las glomerulonefritis
- Las glomerulonefritis (GN) aguda se presenta con hipertensión, edema e IRA. El diagnóstico diferencial se puede dividir en dos categorías principales según los niveles séricos de complemento:
- hipocomplementémico 1. GN postinfecciosas 2. Lupus eritematoso sistémico 3. GN membranoproliferativas.
- normocomplementémico. 1. Nefropatía por IgA 2. Síndrome de Alport 3. Vasculitis ANCA.
El tratamiento de las GN agudas depende de la causa subyacente, la mayoría requieren tratamiento con terapia inmunosupresora. La GNse puede diagnosticar con bastante facilidad al evaluar las GN postinfecciosas,
La necrosis tubular aguda (NTA)
La necrosis tubular aguda (NTA) es la causa más común de IRA. La NTA generalmente es causada una lesión isquémica o por la exposición a medicamentos nefrotóxicos. Los pacientes con NTA son típicamente oligúricos y el sedimento de orina puede mostrar cilindros granulosos o pardos fangosos. En contraste con la azotemia prerrenal, los pacientes con NTA tienen un FENa> 1% (Tabla 1).
El tratamiento de la NTA incluye: reposo renal, mantener la euvolemia y evitar los medicamentos nefrotóxicos. En pacientes oligúricos, es necesario un estricto control de aporte de líquidos para mantener la euvolemia. La recuperación de la NTA puede llevar de días a semanas, y con frecuencia la oliguria hace la transición a poliuria con un aumento constante de la creatinina sérica. Cuando el paciente se vuelve poliúrico, es fundamental mantener una hidratación adecuada. Hasta que los túbulos renales se recuperen, es poco probable que el paciente pueda concentrar su orina y, como tal, corren el riesgo de desarrollar una azotemia prerrenal con posible falla renal secundaria si no se aumenta la ingesta para mantener el rendimiento.
Se debería obtener peso diario de los pacientes, con un balance hídrico estricto y mantener al paciente euvolémico, con 1/3 del volumen de mantenimiento y reemplazar 1:1 con las perdidas por orina. El mantenimiento de 1/3 se aproxima a las pérdidas de líquidos insensibles del paciente, mientras que el reemplazo de la producción de orina trabajará para mantener la euvolemia en pacientes oligúricos y poliúricos. En pacientes que con adecuado debito urinario, se puede reponer volumen con 5% de dextrosa al 0,45% de solución salina normal. Sin embargo, los electrolitos séricos deben ser estrictamente controlados. Los pacientes poliúricos pueden necesitar la adición de potasio a sus líquidos intravenosos. Los pacientes con deposiciones liquidas pueden necesitar repleción adicional para las pérdidas digestivas, incluida la adición de bicarbonato a los líquidos.
Nefritis intersticial aguda (NIA)
Nefritis intersticial aguda (NIA) Es una causa subestimada de AKI. La NIA a menudo se desencadena por una reacción a un medicamento ofensivo y algunas veces se denomina nefritis intersticial alérgica. La NIA también puede ser provocada por una infección viral, sin embargo, la mayoría de las causas de la NIA son idiopáticas. Si bien históricamente, la orina se enviaba para la evaluación de los eosinófilos, la eosinofiluria no es, ni sensible ni específica para el diagnóstico de NIA. La NIA se puede diagnosticar clínicamente en el contexto de un paciente con IRA no oligúrica con un sedimento urinario blando. El tratamiento de NIA en primer lugar, incluye la suspensión del fármaco cuando sea clínicamente posible. Puede tratarse con esteroides, sin embargo, si la causa está relacionada con fármacos, la lesión renal puede reaparecer una vez que se suspenden los esteroides. Existe la asociación con nefritis tubulointersticial y uveítis (TINU).9 Estos pacientes tienen tanto NIA como uveítis. La TINU a menudo responde a los esteroides, sin embargo, la uveítis requiere una evaluación oftalmológica y un tratamiento por separado, además de la evaluación y el tratamiento renal.
Perla clínica: los pacientes con fuga urinaria intraabdominal pueden ser diagnosticados inadecuadamente con IRA. En estos pacientes, su creatinina sérica aumenta de forma secundaria a la reabsorción de creatinina en orina a través de la membrana peritoneal, con un aumento resultante de la creatinina sérica. En este caso, la creatinina sérica ya no refleja la filtración renal. Debe sospecharse en cualquier paciente con desarrollo de ascitis, aumento de creatinina y un procedimiento quirúrgico reciente.
Indicaciones para diálisis
No existe un tratamiento específico para la IRA a parte de las medidas de soporte. La terapia de reemplazo renal puede ser necesaria si el tratamiento médico óptimo no es suficiente. Las indicaciones para iniciar la diálisis aguda incluyen: sobrecarga de volumen, alteraciones electrolíticas, acidosis metabólica o uremia.
Enfermedad renal crónica
La enfermedad renal crónica (ERC) se refiere a la evidencia radiográfica o de laboratorio de una enfermedad renal que progresa más allá de los 3 meses. Hay cinco etapas en ERC, basadas en la tasa de filtración glomerular estimada (Figura 4). En niños con ERC, se usa una versión modificada de la ecuación de Schwartz para estimar la VFG.1,2 A diferencia de los pacientes adultos que a menudo son seguidos por su proveedor de atención primaria durante las primeras etapas de la ERC, todos los niños con ERC deben ser seguidos por un nefrólogo pediátrico para la atención de subespecialidad.10 Se presta especial atención al crecimiento y desarrollo de los niños con ERC. La frecuencia del seguimiento nefrológico se correlaciona con la etapa de la ERC. Cabe destacar que la VFG alcanza su valor máximo alrededor de los 2 años de edad, lo que hace imposible clasificar a los niños menores 2 años con precisión.
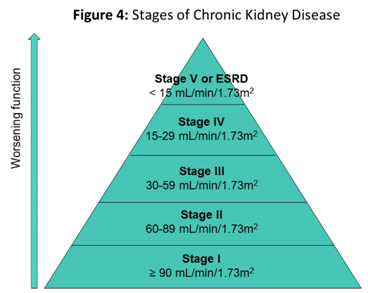
Figura 4
Manejo de la enfermedad renal crónica
Desafortunadamente, no existe una cura para la ERC. Sin embargo, la derivación temprana a un nefrólogo pediátrico puede ayudar con el manejo de las comorbilidades y retrasar la progresión de la enfermedad. El control de rutina de la ERC incluye la etapificación, el control de la presión arterial, así como el control de la anemia, el retraso del crecimiento y la enfermedad metabólica de los huesos.
Control de la presión arterial (PA) : se ha demostrado que un control estricto de la PA hasta percentil 50% para la edad, el sexo y la altura retrasa la progresión de la ERC.11 Los IECA y los ARA II son a menudo el agente preferido para controlar la PA, ya que también protegen contra la hiperfiltración glomerular. Por esta razón, están contraindicados en pacientes con VFG en estadio IV y V o en pacientes que tienden a tener hiperkalemia.
Anemia por enfermedad renal crónica : los niños con ERC tienen varios motivos para ser anémicos, incluida la deficiencia de eritropoyetina y el aumento de los niveles de hepcidina, lo que lleva a una mala utilización de las reservas de hierro.12 Los pacientes con ERC deben someterse a control de hemograma de rutina para controlar la evolución de la anemia. Si se vuelven anémicos, las reservas de hierro deben controlarse y normalizarse. Los pacientes que permanecen anémicos a pesar de las reservas adecuadas de hierro deben iniciar agentes estimulantes de la eritropoyesis como la epoetina alfa o la darbopoetina alfa.10
Enfermedad ósea metabólica (EOM): Anteriormente conocida como hiperparatiroidismo secundario, la enfermedad ósea metabólica abarca no solo el hiperparatiroidismo secundario, sino también la mineralización ósea y las calcificaciones vasculares. La EOM es a menudo el aspecto más desafiante en el manejo de niños con ERC y, desafortunadamente, es la causa del aumento de morbimortalidad en nuestros pacientes pediátricos con ERC. La EOM conduce a un aumento de la enfermedad cardiovascular, la principal causa de muerte en pacientes con ERC. De hecho, un paciente pediátrico con enfermedad renal en etapa terminal tiene los mismos riesgos cardiovasculares de un paciente de 70 años.13 El tratamiento incluye:
- Adecuadas reservas de 25-hidroxi vitamina D,
- Normocalcemia
- Niveles normales de fósforo en suero
- Suplementación de 1-25-dihidroxivitamina D activa.14,2
A menudo la adherencia para los aglutinantes de fósforo prescritos que se toman con las comidas no es buena, causando arcadas y molestias. Esto es particularmente difícil en los niños pequeños, en quienes la hora de comer ya puede ser bastante desafiante.
Crecimiento: Los niños con ERC a menudo tienen dificultades en el crecimiento y desarrollo. Un equipo multidisciplinario que incluya un nutricionista es fundamental para el monitoreo adecuado de la ingesta y el crecimiento nutricional. A diferencia de los adultos con ERC, los niños no tienen un límite de proteínas reducido, ya que requieren proteínas para su crecimiento. Por lo tanto, recomendamos que los niños con ERC obtengan la cantidad diaria recomendada de proteínas. El crecimiento lineal es particularmente desafiante debido a una relativa insensibilidad tisular a la hormona de crecimiento. Los bebés y niños pequeños con ERC a menudo requieren gastrostomía para la administración de medicamentos y / o suplementos. Con frecuencia se requieren fórmulas renales especiales que apoyan el crecimiento y la nutrición, al mismo tiempo que limitan el potasio y el fósforo. La hormona de crecimiento suplementaria está indicada en pacientes que no crecen bien linealmente a pesar de una ingesta calórica adecuada. Desafortunadamente, muchas familias rechazan el tratamiento con hormona de crecimiento para salvar a sus hijos con una inyección diaria, sin embargo, los estudios de calidad de vida han demostrado que la estatura adulta se correlaciona positivamente con la calidad de vida.15,2
Terapia de reemplazo renal (TRR)
Los niños que están progresando a la etapa V requieren de una evaluación para terapia de reemplazo renal. La TRR puede ser en forma de diálisis peritoneal (PD), hemodiálisis (HD) o trasplante renal. Para los pacientes que tienen un posible donante vivo, el trasplante preventivo puede ser una opción adecuada y, a menudo, deseable. La evaluación de un donante vivo puede demorar varios meses, por lo que un trasplante preventivo de este tipo debería comenzar mientras el paciente aún se encuentra en la etapa IV de la ERC. De manera similar, la introducción de los conceptos de diálisis y trasplante en una etapa anterior, como la etapa III, a menudo beneficia a la familia y al paciente para que puedan comenzar a pensar en las modalidades de diálisis en comparación con el trasplante preventivo.
El término "diálisis" se refiere a dos mecanismos separados: 1) difusión de solutos a través de una membrana semipermeable, y 2) remoción de fluido mediante ultrafiltración.
Diálisis peritoneal (DP)
En diálisis peritoneal, el dializado se coloca en la cavidad peritoneal. La membrana peritoneal actúa como la membrana semipermeable y permite que los solutos fluyan a través con su gradiente de concentración. La ultrafiltración se controla mediante la adición de dextrosa al líquido de dializado. Al aumentar la concentración de dextrosa en el dializado, el gradiente osmótico aumenta y, por lo tanto, extrae más líquido del paciente hacia la cavidad peritoneal. Luego se drena el líquido del peritoneo. La mayoría de los pacientes pediátricos se someten a la DP mientras duermen en sus casas. De esta manera, se someten a varios ciclos, generalmente entre 6 y 12 ciclos. Por lo tanto, la prescripción de DP incluye el volumen de llenado, el tiempo de permanencia y el dializado que se utilizará (incluida la concentración de dextrosa). El volumen adicional que se drena durante cada ciclo de drenaje es registrado y el total acumulado durante el tratamiento se denomina volumen de ultrafiltrado (VUF). Cabe destacar que los pacientes pueden retener líquidos durante la DP y esto generalmente indica que podrían haber sido hipovolémicos al inicio del tratamiento. La DP domiciliaria requiere una amplia capacitación de los cuidadores con una comunicación frecuente con su centro de nefrología. Se espera que los cuidadores mantengan registros diarios de los pesos previos y posteriores al tratamiento, la presión arterial, el dializado usado y el VUF obtenido. Muchos pacientes tienen una prescripción de escala móvil de manera tal que la concentración de dextrosa se puede ajustar en función de su peso y de la presión arterial anteriores a la diálisis.
La peritonitis es el principal riesgo en los pacientes sometidos a DP. Se enseña a los cuidadores a reconocer los signos y síntomas de la peritonitis. Como también están capacitados para obtener una muestra de liquido peritoneal para el recuento de células y el cultivo antes de iniciar los antibióticos intraperitoneales. Los pacientes con DP que toman antibióticos siempre deben recibir profilaxis antifúngica para prevenir la peritonitis fúngica. La peritonitis fúngica es tan difícil de diagnosticar como de tratar, y desafortunadamente requiere la extracción del catéter de DP con un alto riesgo de cicatrización de la membrana peritoneal.
La falla de la membrana puede deberse a una peritonitis fúngica, una peritonitis bacteriana recurrente o puede ser el resultado de una glicosilación de la membrana por exposición prolongada a la dextrosa. El nefrólogo debería realizar pruebas de membrana peritoneal de rutina para evaluar las características de la esta y así ajustar las órdenes de DP a lo largo del tiempo.
Hemodiálisis (HD)
En la hemodiálisis, la sangre del paciente circula a través de una máquina de diálisis que contiene un filtro de HD. La mayoría de los filtros son membranas capilares de fibra hueca. Cada fibra es hueca y permite que la sangre fluya a través del tubo, en contracorriente al dializado que fluye alrededor de las fibras. Este diseño permite una gran área de superficie donde las fibras son la membrana semipermeable permitiendo un flujo de solutos a través de la membrana con una gradiente de concentración. El UF se alcanza a través de la presión negativa aplicada por la máquina de diálisis. La tasa de UF está limitada por el tamaño del paciente, la presión arterial y la clínica. El acceso a diálisis puede ser un reto en pacientes pediátricos. A menudo, el acceso a la fístula está limitado por el tamaño del paciente y la vasculatura. Como resultado, muchos pacientes pediátricos tienen el riesgo adicional de infección del acceso central, que es mayor que las fistulas.10
La elección de la modalidad de diálisis se realiza en función de una combinación del estado médico del paciente, la enfermedad subyacente, el apoyo familiar y, a menudo, la ubicación geográfica (es decir, la distancia desde un centro de hemodiálisis que tratará a los niños). Los antecedentes de peritonitis o procedimientos quirúrgicos que han dejado adherencias pueden limitar la opción de realizar diálisis peritoneal. Ciertamente, la diálisis peritoneal requiere mayor estabilidad social, así como tiempo, energía y compromiso por parte de los cuidadores. A pesar de estas responsabilidades adicionales, la PD a menudo es una opción preferida ya que le permite al niño continuar asistiendo a la escuela. Alternativamente, la hemodiálisis (HD) es una buena alternativa para los pacientes en que falló la PD o que su familia no pueda proporcionar la PD en casa.
Independientemente de la modalidad de diálisis elegida, el objetivo de todo programa de nefrología pediátrica es trasplantar con éxito a sus pacientes pediátricos con ERC terminal. La esperanza de vida de los niños con ERC terminal en diálisis es 50 años más corta que las cohortes sanas y de igual edad, en comparación con 15 años menos después del trasplante.13 La evaluación de trasplante incluye la evaluación psicosocial y, a veces, el trasplante se retrasa o se suspende si el niño no está interesado o se considera un mal candidato debido al incumplimiento de las terapias prescritas.
Referencias
-
Schwartz GJ and Work DF. Measurement and estimation of GFR in children and adolescents. Clin J Am Soc Nephrol 2009; 4: 1832–43. ↩ ↩2
-
Ariceta G and Rodriguez-Soriano J. Inherited renal tubulopathies associated with metabolic alkalosis: effects on blood pressure. Semin Nephrol 2006; 26: 422–33. ↩ ↩2 ↩3 ↩4
-
Fanconi A and Prader A. Primary tubulopathies. I. A case of idiopathic renal tubular acidosis (Albright's syndrome). _Helv Paediatr Acta, 1961; 16: 609-21. ↩
-
Cadnapaphornchai MA, et al. Neonatal Nephrology. Merenstein & Gardner's Handbook of Neonatal Intensive Care, ed. S.L. Gardner, et al. 2015. ↩
-
Sutherland SM, et al. AKI in hospitalized children: comparing the pRIFLE, AKIN, and KDIGO definitions. Clin J Am Soc Nephrol 2015; 10: 554–61. ↩
-
Akcan-Arikan A, et al. Modified RIFLE criteria in critically ill children with acute kidney injury. Kidney Int 2007; 71: 1028–35. ↩
-
Musu M, et al. Acute nephrotoxicity of NSAID from the foetus to the adult. Eur Rev Med Pharmacol Sci 2011; 15: 1461–72. ↩
-
Goldstein SL, et al. Electronic health record identification of nephrotoxin exposure and associated acute kidney injury. Pediatrics 2013; 132: e756–67. ↩
-
Yitzhaki P. Tubulo-interstitial nephritis and uveitis syndrome–TINU syndrome. Harefuah 2000; 138: 360–2. ↩
-
Lamb EJ, Levey AS, and Stevens PE. The Kidney Disease Improving Global Outcomes (KDIGO) guideline update for chronic kidney disease: evolution not revolution. Clin Chem 2013; 59: 462–5. ↩ ↩2 ↩3
-
Group ET, et al. Strict blood-pressure control and progression of renal failure in children. N Engl J Med 2009; 361: 1639–50. ↩
-
Atkinson MA, et al. Hepcidin and risk of anemia in CKD: a cross-sectional and longitudinal analysis in the CKiD cohort. Pediatr Nephrol 2015; 30: 635–43. ↩
-
Mitsnefes MM. Cardiovascular disease in children with chronic kidney disease. J Am Soc Nephrol 2012; 23: 578–85. ↩ ↩2
-
Wesseling-Perry K and Salusky IB. Chronic kidney disease: mineral and bone disorder in children. Semin Nephrol 2013; 33: 169–79. ↩
-
Goldstein SL, Gerson AC, and Furth S. Health-related quality of life for children with chronic kidney disease. Adv Chronic Kidney Dis 2007; 14: 364–9. ↩









