Embriología del tracto urinario
Kathleen Kieran, MD; Christopher S. Cooper, MD
Departamento de Urología de la Universidad de Iowa, Iowa City, IA, USA
Traducido y editado desde el original al español | Enlace a la versión en inglés
Dra Maria Santos, Dra Carolina Acuña
Hospital Padre Hurtado, Santiago Chile
Es fundamental entender la embriología de los genitales y del sistema urinario para así comprender la función normal y patológica de estos órganos. Si bien, los genitales y el sistema urinario tienen funciones distintas, comparten orígenes embriológicos.
Los riñones
El desarrollo de los riñones se divide en tres etapas: los pronefros, los mesonefros y los metanefros. El pronefros se desarrolla en la tercera semana de gestación como una condensación del mesodermo intermedio en las regiones cervical inferior y torácica superior extendiéndose hasta la cloaca.1 Involuciona casi por completo en la cuarta semana de gestación (Figura 1).
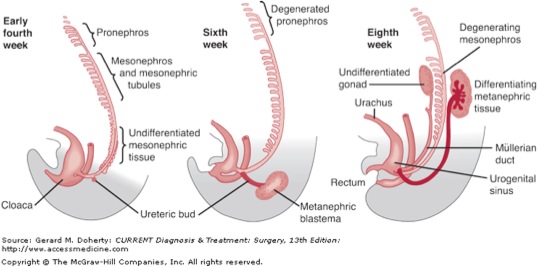
Figura 1
El conducto pronéfrico, que surge de las evaginaciones dorsal y caudal de los pronefros, se conserva y dará lugar al conducto mesonéfrico. El mesonefros se desarrolla más caudalmente, a partir del mesodermo intermedio; Aunque la mayoría de estos túbulos se degeneran, el conducto mesonéfrico persiste bilateralmente. En ambos sexos, los uréteres, la pelvis renal y el trígono vesical se derivan del conducto mesonéfrico; en el varón, el conducto mesonéfrico también da lugar a los vasos deferentes, epidídimos y vesículas seminales; el primero es parte del propio conducto, mientras que las dos últimas estructuras surgen como resultado de la dilatación o evaginación del conducto (Figuras 2, 3).
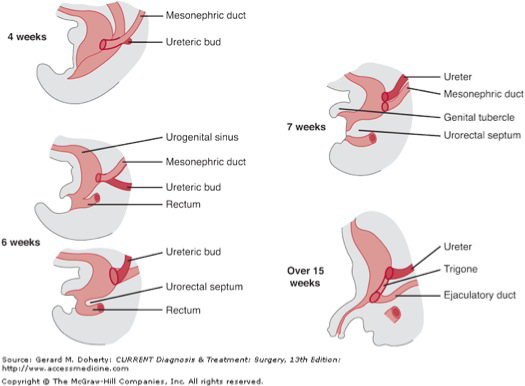
Figura 2
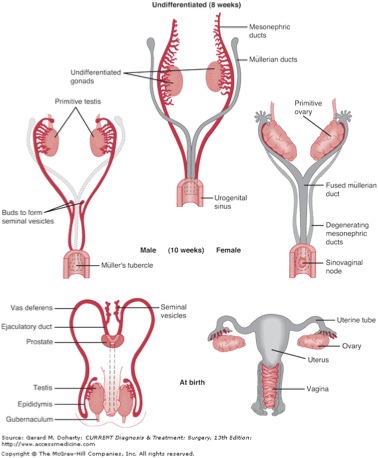
Figura 3
Una vez que el conducto mesonéfrico entra en contacto con la cloaca en el aspecto caudal del embrión, crece cranealmente como el brote uretérico hasta que entra en contacto con el mesénquima metanéfrico, formando el metanefros.
La yema ureteral y el mesénquima metanéfrico inducen recíprocamente el crecimiento, formando el riñón. El brote ureteral se agranda y se divide progresivamente para formar la pelvis renal, infundíbulos, conductos colectores y 8-12 cálices mayores y menores.1,2 La ramificación del brote uretérico se controla mediante la interacción del factor neurotrófico derivado de células gliales (GDNF) y el receptor RET-1, con la activación subsiguiente de Wnt-11.3,4 La proteína morfogenética ósea (BMP)-4 actúa localmente para disminuir la génesis y la ramificación de las yemas ureterales. Parece también estar involucrada en la prevención de la ectopia de las yemas ureterales y en la promoción del desarrollo del musculo liso periureteral.5 Gremlin 1 (grem 1), un antagonista de BMP-4, normalmente está presente alrededor de la yema uretérica, disminuyendo localmente la actividad de BMP-4 y permitiendo así la ramificación ureteral. Existen también muchos otros genes y proteínas que han sido implicados en el desarrollo renal.6 Los túbulos colectores invaginan el mesodermo metanéfrico para formar vesículas metanéfricas, que posteriormente se alargan para formar los túbulos metanéfricos. A medida que los túbulos metanéfricos están invaginados por capilares (glomérulos), se forman nefrones. Este proceso continúa hasta la semana 32 de gestación. Al nacer, aproximadamente 750,000 a 1 millón de nefronas están presentes en cada riñón; después del nacimiento, el tamaño renal puede aumentar debido a la elongación de los túbulos contorneados proximales.7
Con el crecimiento longitudinal diferencial del embrión, el riñón "asciende" desde su ubicación inicial en la pelvis hasta su ubicación final en el retroperitoneo superior. Durante el ascenso, los vasos sanguíneos transitorios ascienden y luego se degeneran; estas arterias persisten en los riñones ectópicos, así como en algunas unidades renales ortotópicas. Al mismo tiempo, los riñones giran alrededor de sus ejes vertical y horizontal, de modo que su orientación final los polos superiores son ligeramente más mediales y anteriores que los polos inferiores (Figura 4).8
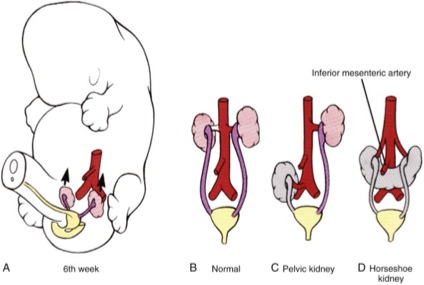
Figura 4
Vejiga
Hasta la semana 7 de gestación, el embrión tiene una cloaca y un orificio único hacia caudal. Durante la semana 7 de gestación, la membrana urogenital crece de forma caudal, dividiendo la cloaca en componentes ventral (seno urogenital) y dorsal (recto) (Figura 5).
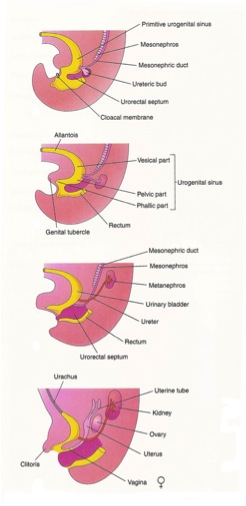
Figura 5
El seno urogenital puede subdividirse en porciones craneales (vejiga futura) y caudales (próstata futura, uretra y genitales externos). El epitelio vesical deriva de la capa endodérmica del seno urogenital. Como se señaló anteriormente, el conducto mesonéfrico da lugar al uréter. Con el crecimiento caudal continuo del embrión, el extremo proximal (vejiga) del conducto mesonéfrico es atraído progresivamente en sentido caudal, de manera que la porción común del conducto mesonéfrico se transforma en el trígono vesical y el seno urogenital. Las ramas del conducto mesonéfrico se convierten en los conductos genitales masculinos y los uréteres, que ahora son entidades distintas unidas al seno urogenital. Aunque generalmente se acepta que el trígono deriva de los conductos mesonéfricos, la forma en que se logra no esta del todo comprendida. Un estudio reciente sugiere que el trígono puede formarse a través de la apoptosis mediada por la vitamina A del conducto néfrico común en lugar de la incorporación de los conductos mesonéfricos.9,10 También se ha postulado un origen endodérmico del trígono.11
A medida que el embrión continúa creciendo longitudinalmente, los orificios de las "ramas" de los conductos mesonéfricos se alejan progresivamente, los orificios ureterales se mueven de forma craneal y los conductos genitales masculinos se mueven de forma caudal y medial. En los casos en que el origen de la yema uretérica es más distal de lo normal, la incorporación del conducto mesonéfrico en el trígono no produce dos conductos discretos hasta mucho más tarde; como tal, los conductos genitales masculinos tendrán una ubicación ortotópica, pero el orificio ureteral estaría localizado más medial y caudal de lo habitual. En casos graves, en que el origen de la yema ureteral es muy distal en el conducto mesonéfrico, (incluso después de la incorporación del conducto mesonéfrico en el trígono), el orificio ureteral se abre hacia los conductos genitales masculinos. A la inversa, los pacientes en los que la bifurcación del conducto mesonéfrico y la yema uretérica son más proximales de lo habitual suelen tener un orificio ureteral que se desplaza lateralmente. Las yemas ureterales con ectopia significativa a menudo se asocian con displasia renal.12,13
Las capas no epiteliales de la porción del detrusor (no trígono) de la vejiga surgen de condensaciones del mesénquima esplácnico. El lumen del alantoides que conecta la vejiga y la pared abdominal anterior, se cierra con el tiempo y produce el uraco. Con el tiempo, el uraco se vuelve más fibrótico y se convierte en el ligamento umbilical medio.
Próstata
La glándula prostática deriva del seno urogenital y el endodermo se invagina en el mesénquima circundante en las semanas 9-11 de gestación (Figura 6).14
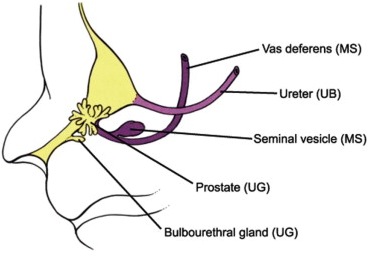
Figura 6
La glándula se agranda y madura gracias al efecto inductor que tiene el mesénquima y el endodermo sobre el otro.15 El desarrollo de la próstata es un proceso dependiente de andrógenos; el mesénquima, en lugar del endodermo, requiere de andrógenos para el adecuado desarrollo prostático.16 Al igual que con el desarrollo renal, las investigaciones en curso continúan identificando genes y proteínas esenciales para el desarrollo prostático, incluyendo Shh, Sox-9 , FGF, Wnt, Hox y Fox.17
Uretra
La uretra es derivada del seno urogenital, con endodermo que da lugar al epitelio y mesénquima esplácnico que a su vez da lugar al tejido blando circundante. En los hombres, la parte más distal de la uretra (la porción glanular) parece surgir de una invaginación ectodérmica que luego se une con el epitelio endodérmico de la uretra proximal para crear un canal continuo (ver pene).18
Gónadas
En la quinta semana de gestación, las condensaciones del epitelio mesodérmico y el mesénquima subyacente forman las crestas gonadales laterales al mesonefros. Las células germinales primordiales cerca del alantoides en el lado ventral del embrión se mueven dorsalmente a medida que el embrión se pliega. Estas células germinales se recogen en grupos de epitelio llamados cordones sexuales, que invaginan el tejido mesenquimatoso local y migran a las crestas gonadales. Hasta la séptima semana, las gónadas de los embriones masculinos y femeninos son idénticas. La diferenciación de las gónadas en un testículo u ovario se determina por el sexo cromosómico del embrión (46XY o 46XX; Figura 7).
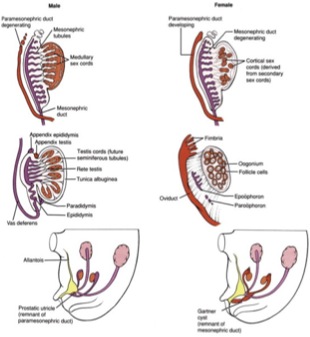
Figura 7
El factor determinante de los testículos (TDF, también conocido como el gen Sry) encontrado en Yp (el brazo corto del cromosoma Y) es crucial para el desarrollo de la gónada indiferenciada en un testículo;19 Cuando hay TDF, los cordones sexuales gonadales se organizan en futuros túbulos seminíferos con una cápsula engrosada (túnica albugínea). Los genes Sox-9 y DAX-1 también están involucrados en la diferenciación gonadal.20,21 El tejido mesenquimático que se encuentra entre los túbulos seminíferos se diferencia en las células de Leydig, que sintetizan la testosterona en respuesta a la estimulación de hCG entre las semanas 8 y 12 de gestación. Los conductos mesonéfricos (wolffianos) y los genitales externos son masculinizados en respuesta a la testosterona. Las células de Sertoli de los testículos, que se originan del epitelio de la superficie bajo el control de DAX-1 se incorporan a las paredes de los túbulos seminíferos secretando hormona antimülleriana (influenciada por SF-1 y WT-1) lo que lleva a la desintegración de los conductos paramesonefricos (Müllerian).22,23 Es importante destacar que los túbulos seminíferos no desarrollan su lumen hasta la pubertad.
En lo contrario, los embriones con un genotipo 46, XX o en quienes TDF no está presente desarrollarán ovarios.24 Generalmente se necesitan dos cromosomas X para el desarrollo ovárico normal.25 Los cordones sexuales primarios que se extienden hacia la médula de manera análoga al desarrollo de los testículos se degeneran posteriormente.26 Los cordones sexuales secundarios, que crecen desde el epitelio de la superficie al mesénquima subyacente, incorporan células germinales primordiales, pero luego se rompen en grupos llamados folículos primordiales, cada uno de los cuales consiste en una ovogonia: una célula germinal rodeada por células foliculares derivadas del cordón sexual; el número de folículos aumenta con la mitosis prenatal (que no continúa después del nacimiento). Aunque la mayoría de las ovogonias se degeneran antes de nacer, las que no lo hacen seguirán creciendo y convirtiéndose en ovocitos primarios.27
El desarrollo de los conductos mesonéfricos ya ha sido discutido. Los conductos paramesonéfricos, laterales a los conductos mesonéfricos, se extienden desde el peritoneo hasta la futura pelvis del embrión. Los conductos paramesonéfricos se fusionan en la pelvis, formando el útero y los dos tercios superiores de la vagina en las mujeres (Figura 8).
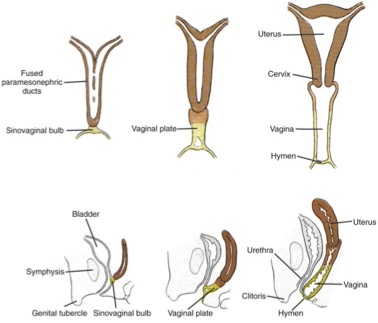
Figura 8
Las porciones no fusionadas de los conductos se convierten en las trompas de Falopio. El mesénquima esplácnico da lugar al estroma uterino y al revestimiento, mientras que el epitelio de la vagina surge del endodermo y del seno urogenital. Un tabique transversal divide las porciones de la vagina derivadas del seno urogenital y los sistemas de Müller, y típicamente se rompe (dejando el himen) poco antes del nacimiento.28,29,30
Las regiones de la gónada se hacen evidentes en la sexta semana de gestación.31
Genitales externos
La diferenciación de los genitales externos en variantes masculinas y femeninas comienza en la séptima semana de gestación. Un tubérculo genital surge de las condensaciones de mesénquima cerca de la cloaca embrionaria en la cuarta semana de gestación; en ambos lados, se producen inflamaciones de labios escrotal (genitales) y pliegues urogenitales (uretrales). El tabique urorectal crece hacia la cloaca, y al final de la sexta semana de gestación se divide la cloaca en porciones urogenital (anterior) y anal (posterior).
En el hombre, la exposición a los andrógenos produce un crecimiento del tubérculo genital para formar un falo, y los pliegues urogenitales forman los bordes laterales del surco uretral. Finalmente se fusionarán ventralmente para cubrir la placa uretral (endodermo), que está contenida dentro el surco uretral.32 La uretra además está cubierta por ectodermo. El desarrollo de la uretra glanular es debatido; una teoría es que se produce una tubularización de la placa uretral a partir de la fusión de los pliegues labioescrotales que continúa distalmente de la misma manera que se realiza en forma proximal.33 Mientras que otra teoría sostiene que la invaginación ectodérmica de la punta del glande con el subsiguiente contacto con la uretra peneana forma una uretra completamente canalizada.15 Actualmente se cree que la teoría anterior es correcta. Los cuerpos cavernosos emparejados y el cuerpo esponjoso único surgen de condensaciones mesenquimatosas.34,35 El escroto se deriva de la fusión proximal de los pliegues labioescrotales.15,36,37,38
En la mujer, hay un crecimiento mínimo del tubérculo genital, que se desarrolla en el clítoris. Posteriormente, los pliegues urogenitales se fusionan mínimamente para producir la horquilla posterior del orificio vaginal; anteriormente, las porciones no fusionadas se convierten en los labios menores. Los pliegues urogenitales no se fusionan y dan lugar a los labios mayores. Estos cambios morfológicos pueden estar mediados, al menos en parte, por el gen Shh.39
El crecimiento y la ramificación del tejido uretral en el mesénquima circundante da lugar a glándulas uretrales y glándulas parauretrales (de Skene). El seno urogenital tiene bolsas que se convertirán en glándulas de Bartholino (vestibular). Los análogos masculinos de estas estructuras son la próstata (glándulas parauretrales) y las glándulas bulbouretrales (glándulas vestibulares).
Referencias
-
Moore KL, Persaud TVN. The urogenital system. In The Developing Human: Clinically Oriented Embryology, 8th ed. Philadelphia: Saunders, 2003; chapter 12, pp. 243-283. ↩ ↩2
-
Yu, J, McMahon, A P and Valerius, MT. Recent genetic studies of mouse kidney development. Curr Opin Genet Dev 2004; 14, 550–557. ↩
-
Michos O, Panman L, Vintersten K, et al. Gremlin-mediated BMP antagonism induces the epithelial-mesenchymal feedback signaling controlling metanephric kidney and limb organogenesis. Development 2004; 131: 3401–10. ↩
-
Majumdar A, Vainio S, Kispert A, et al. Wnt11 and REt/Gdnf pathways cooperate in regulating ureteric branching during metanephric kidney development. Development 2003; 130: 3175–85. ↩
-
Wang GJ, Brenner-Anantharam A, Vaughan ED, et al. Antagonism of BMP4 signaling disrupts smooth muscle investment of the ureter and ureteropelvic junction. J Urol 2009; 181: 401–7. ↩
-
Stuart RO, Bush KT, Nigam SK. Changes in gene expression patterns in the ureteric bud and metanephric mesenchyme in models of kidney development. Kidney Int 2003; 64: 1997–2008. ↩
-
Bertram JF, Douglas-Denton RN, et al. Human nephron number: implications for health and disease. Pediatr Nephrol 2011; 26: 1529–33. ↩
-
Friedland GW, deVries P. Renal ectopia and fusion. Embryologic basis. Urology 1975; 5: 698–706. ↩
-
Batourina E, Tsai S, Lambert S, et al. Apoptosis induced by vitamin A signaling is crucial for connecting the ureters to the bladder. Nat Genet 2005; 37: 1082–9. ↩
-
Viana R, Batourina E, Huang H, et al.The development of the bladder trigone, the center of the anti-reflux mechanism. Development 2007; 134: 3763–9. ↩
-
Tanaka ST, Ishii K, Demarco RT, et al. Endodermal origin of bladder trigone inferred from mesenchymal-epithelial interaction. J Urol 2010; 183: 386–91. ↩
-
Mackie GG, Stephens FD. Duplex kidneys: a correlation of renal dysplasia with position of the ureteral orifice. J Urol 1975: 114: 274–80. ↩
-
Schwarz RD, Stephens FD, Cussen LJ. The pathogenesis of renal dysplasia. II. The significance of lateral and medial ectopy of the ureteric orifice. Invest Urol 1981; 19: 97–100. ↩
-
Thomson AA. Role of androgens and fibroblast growth factors in prostatic development. Reproduction 2001; 121: 187–95. ↩
-
Kurzrock EA, Baskin LS, Cunha GR. Ontogeny of the male urethra: theory of endodermal differentiation. Differentiation 1999; 64: 115–22. ↩ ↩2 ↩3
-
Lasnitzki I, Mizuno T. Prostatic induction: interaction of epithelium and mesenchyme from normal wild-type mice and androgen-insensitive mice with testicular feminization. J Endocrinol 1980; 85: 423–8. ↩
-
Meeks JJ, Schaeffer EM. Genetic regulation of prostate development. J Androl 2011; 32: 210–7. ↩
-
Krishnan A, de Souza A, Konijeti R, et al. The anatomy and embryology of posterior urethral valves. J Urol 2006; 175: 1214–20. ↩
-
Berta P, Hawkins JR, Sinclair AH, et al. Genetic evidence equating SRY and the testis-determining factor. Nature 1990; 348: 448–50. ↩
-
McElreavey K, Barbaux S, Ion A, Fellous M. The genetic basis of murine and human sex determination: a review. Heredity 1995; 75: 599–611. ↩
-
Vilain E, McCabe ER. Mammalian sex determination: from gonads to brain. Mol Genet Metab 1998; 65: 74–84. ↩
-
Rey R, Lukas-Croisier C, Lasala C, et al. AMH/MIS: what we know already about the gene, the protein and its regulation. Mol Cell Endocrinol 2003; 211: 21–31. ↩
-
Rey R, Grinspon RP. Normal male sexual differentiation and aetiology of disorders of sex development. Best Pract Res Clin Endocrinol Metab 2011; 25: 221–38. ↩
-
Hawkins JR, Taylor A, Berta P, et al. Mutational analysis of SRY: nonsense and missense mutations in XY sex reversal. Hum Genet 1992; 88: 471–4. ↩
-
Simpson JL. Gonadal dysgenesis and abnormalities of the human sex chromosomes: current status of the phenotypic-karyotypic correlations. Birth Defects 1975; 11: 23–59. ↩
-
Merchant-Larios H, Centeno B. Morphogenesis of the ovary from the sterile W/Wv mouse. Prog Clin Biol Res 1981;59B:383-92. ↩
-
Oktem O, Oktay K. The ovary: anatomy and function throughout human life. Ann N Y Acad Sci 2008; 1127: 1–9. ↩
-
Cunha CR. The dual origin of vaginal epithelium. Am J Anat 1975; 143: 387–92. ↩
-
Kobayashi A, Behringer RR. Developmental genetics of the female reproductive tract in mammals. Nat Rev Genet 2003; 4: 969–80. ↩
-
Spencer TE, Dunlap KA, Filant J. Comparative developmental biology of the uterus: insights into mechanisms and developmental disruption. Mol Cell Endocrinol (in press). ↩
-
McKay DG, Hertig AT, Adams EC, et al. Histochemical observations on the germ cells of human embryos. Anat Rec 1953; 117: 201–19. ↩
-
Baskin LS, Erol A, Jegatheesan P, et al. Urethral seam formation and hypospadias. Cell Tissue Res 2001; 305: 379–87. ↩
-
Seifert AW, Harfe BD, Cohn MJ. Cell lineage analysis demonstrates an endodermal origin of the distal urethra and perineum. Dev Biol 2008; 318: 143–52. ↩
-
Baskin LS, Lee YT, Cunha GR. Neuroanatomical ontogeny of the human fetal penis. Br J Urol 1997; 79: 628–40. ↩
-
Yiee JH, Baskin LS. Penile embryology and anatomy. ScientificWorldJournal 2010; 10: 1174–9. ↩
-
Feldman KW, Smith DW. Fetal phallic growth and penile standards for newborn male infants. J Pediatr 1975; 86: 395–8. ↩
-
Zalel Y, Pinhas-Hamiel O, Lipitz S, et al. The development of the fetal penis – an in utero sonographic evaluation. Ultrasound Obstet Gynecol 2001; 17: 129–31. ↩
-
Kluth D, Fiegel HC, Geyer C, et al. Embryology of the distal urethra and external genitals. Semin Pediatr Surg 2011; 20: 176–87. ↩
-
Miyagawa S, Matsumaru D, Murashima A, et al. The role of sonic hedgehog-Gli2 pathway in the masculinization of external genitalia. Endocrinology 2011: 152: 2894–903. ↩









