Problemas genitourinarios en pacientes con malformaciones ano rectales (ARM)
Stephanie Warne MD FRCS, Duncan Wilcox MD FRCS
Children’s Hospital Colorado, Aurora, CO, USA
Traducido y editado desde el original al español | Enlace a la versión en inglés
Francisca Yankovic
Hospital Exequiel Gonzalez Cortes, Santiago Chile
Las malformaciones ano rectales representan un espectro de anormalidades congénitas en las que el ano no se abre anormalmente en el perineo y ocurre en aproximadamente 1 de cada 5,000 nacidos vivos1,2. La cloaca persistente es el tipo más grave de malformación ano rectal que se encuentra y se observa en niñas donde el recto, la uretra y la vagina no logran desarrollarse y drenan a través de un solo canal anormal perineal3. La cloaca representa alrededor del 10% de todos los pacientes con ARM nuevos y, a pesar de la complejidad de este grupo, generalmente no se tratan por separado4. Las malformaciones cloacales tienen una alta incidencia de anomalías asociadas y el defecto puede ocurrir como parte de un síndrome como el VACTERL (vertebral, ano rectal, cardíaco, tráquea-esofágico, renal y de extremidades) o síndrome de regresión caudal5,6.
En paciente portadores de una malformación ano rectal (ARM) las anomalías más comúnmente asociadas incluyen afecciones del tracto urinario, genitales, vertebrales y sacras, así como el sistema cardiovascular, respiratorio, gastrointestinal y nervioso central 7,8. El manejo de los pacientes con ARM ha sido un desafío para los cirujanos y urólogos pediátricos y el resultado más común y temido es la incontinencia fecal. A medida que se dispone de más datos de resultados a largo plazo, parece que la incontinencia urinaria, la disfunción sexual y los problemas de fertilidad también pueden afectar a los pacientes nacidos con defectos anorectales9,10.
EMBRIOLOGÍA
Los bebés con malformaciones ano rectales tienen un amplio espectro de enfermedades con diferentes grados de complejidad4. De acuerdo con el concepto de regresión caudal, la tabicación cloacal anómala se asocia con el desarrollo anormal de otros sistemas de órganos cercanos, como las vértebras, las estructuras que dependen del brote ureteral y los derivados de los conductos mulleriano6.
Independientemente del mecanismo, está claro que la separación de la cloaca y el desarrollo de displasia renal son eventos embrionarios tempranos11-13.
En la malformación cloacal hay una abertura perineal única para los tractos genital, urinario y gastrointestinal14-15. Embriológicamente, esta confluencia normalmente persiste hasta aproximadamente las 5 semanas de gestación. La cloaca es normalmente una estructura transitoria durante el desarrollo embrionario que se forma a partir del pliegue de la cola en desarrollo por la confluencia del alantoides y el intestino posterior16-18. En el pasado, se pensaba que la partición de la cloaca se producía por el crecimiento craneocaudal de una estructura mesenquimal llamada tabique urorectal y la migración simultánea de indentaciones laterales cerca de la membrana cloacal (4-5 semanas de gestación)17-21
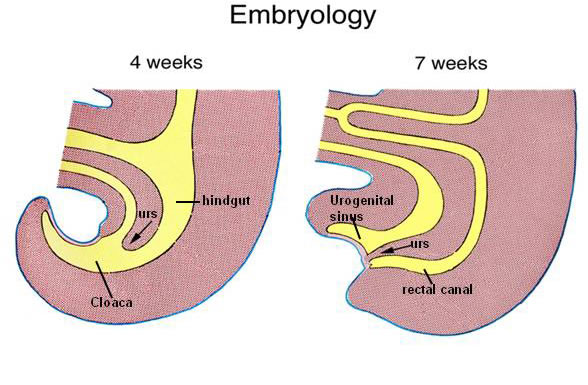
Figura 1
Sin embargo, ahora se sabe que el mesénquima entre el intestino posterior y la vejiga en desarrollo parece aproximarse a la placa cloacal, pero lo que anteriormente se pensaba que era el tabique urorrectal, se crea por los cambios en el tamaño relativo y la posición de las estructuras mesenquimales que rodean la cloaca mientras crece 20-22.Para la sexta semana, la cloaca se divide en un seno urogenital anterior y un intestino posterior separado. Los conductos mesonéfricos se unen lateralmente a la cloaca y dan lugar al desarrollo del brote ureteral, que a su vez induce el desarrollo renal desde el blastema metanéfrico16. La uretra se desarrolla posteriormente desde el extremo caudal del seno urogenital después de su separación de la cloaca 23.
Las malformaciones ano rectales y la cloaca persistente pueden deberse a la detención de la división de la cloaca por el crecimiento mesenquimal y pueden ocurrir en cualquier etapa de este proceso, lo que conduce a un amplio espectro de malformaciones ano rectales 16,17. La asociación íntima de desarrollo embriológico de los sistemas ano rectales, genitales y urinarios también explica la frecuencia con la que ocurren las malformaciones asociadas simultáneas en estos sistemas 4,15. A medida que la biología molecular ofrece más información sobre los desencadenantes moleculares para el desarrollo, se aprenderá más sobre la patogenia de las ARM 20.
ETIOLOGIA Y GENETICA
La causa de la ARM es desconocida. Los determinantes moleculares durante la blastogénesis se superponen para muchos sistemas corporales, por lo que los defectos a menudo involucran dos o más campos progenitores 24. Se han informado de ARM esporádicas, pero más comúnmente se encuentran asociadas con otras malformaciones sistémicas 25. La genética es compleja, ya que los fenotipos ARM son el resultado de múltiples genes 26. Puede ser que eventos embrionarios similares a los que producen la atresia esofágica sean responsables de las ARM. En un modelo de ratón, el gen SHH Sonic Hedgehog muestra una relación con las anomalías gastro intestinales superiores e inferiores 27,28.
La ARM se ha descrito en pacientes con anomalías cromosómicas, como el síndrome de Down, la trisomía 18 y el síndrome del ojo de gato 13q. Cuschieri informó que se encontraron anomalías cromosómicas en el 11% de una gran serie de bebés europeos con ARM. Las frecuencias de la trisomía 21, 13 y 18 en este grupo de bebés fueron 15, 30, 90 veces más altas que la población general 29. El efecto teratogénico de sustancias químicas como la talidomida, el estrógeno y el etanol también se ha descrito 30.
Síndromes genéticos
Muchos síndromes se han descrito con ARM como una característica. VACTERL, regresión caudal y síndromes de Currarino se describirán a continuación, pero otros como CHARGE, Goldehhaar, Renal-ear-anal-radial, Pallister Hall, Opitz y el síndrome del ojo de gato también se han descrito 30.
VATER
El síndrome de VATER fue descrito por primera vez por Quan y ocurre en 1 de 5,000-10,000 nacimientos vivos y parece representar un defecto de campo8. VACTERL es un acrónimo de anomalías vertebrales, malformación ano rectal, anomalías cardíacas, fístula traqueo esofágica, anomalías renales y anomalías de las extremidades. Casi todos los casos de VACTERL son esporádicos, por lo que el riesgo de recurrencia para las familias es mínimo. Sin embargo, en pacientes VACTERL con hidrocefalia se ha notificado una mutación con el gen PTEN 31.
Síndrome de regresión caudal (CRS)
Este síndrome se debe a una falla en la formación de parte o la totalidad de las unidades vertebrales coccígea, sacra y ocasionalmente lumbar y los segmentos correspondientes de la médula espinal caudal. Se asocia comúnmente con la ARM (27-48%) y las anomalías genitourinarias 32. La mayoría de los casos de síndrome de regresión caudal es esporádico. Sin embargo, el CRS ocurre en el 1% de los embarazos de mujeres diabéticas y el 22% de las pacientes con CRS tienen antecedentes de diabetes materna durante el embarazo. Las madres con diabetes dependiente de la insulina tienen 200-400 veces más probabilidades de tener un hijo con SRC 30,33.
Síndrome de Currarino
Esta tríada se describió por primera vez como ARM con hemi sacro y masa pre-sacra 34. El síndrome de Currarino puede ser esporádico con el modo de herencia autosómico dominante y con penetrancia variable 30. El gen HLXB9 en 7q39 se identificó por análisis de ligamiento como gen causal 35.
CLASIFICACIÓN DE MALFORMACIONES ANORECTALES Y CLOACALES
El término malformación ano rectal representa un amplio espectro de anomalías que involucran la terminación del intestino posterior. Los cirujanos y anatomistas pediátricos han tratado de clasificar las malformaciones ano rectales de una manera racional 36. Los términos "alto" y "bajo" han sido el concepto más aceptado. La clasificación internacional 37 y la clasificación de Wingspread 38 propusieron "alto", "intermedio" y "bajo" para clasificar a los pacientes con ARM, mientras que Peña clasifica la condición según el sitio de la fístula, el grado de regresión caudal y, por lo tanto, el pronóstico 39 (Tabla 1)
Tabla 1
| MASCULINO | FEMENINO | |
|---|---|---|
| Fístula rectovesical (cuello vesical) | Cloaca canal común>3 cm canal común<3 cm | |
| Fístula recto uretral (prostática) | | |
| Fístula recto uretral (bulbar) | Fistula recto vestibular | |
| Atresia rectal | Atresia rectal | |
| Ano imperforado sin fístula | Ano imperforado sin fístula | |
| Fistula perineal | Fistula perineal | |
Las fístulas perineales
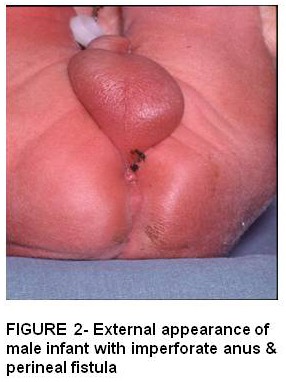
Las fístulas perineales se han llamado tradicionalmente defectos bajos en niños y niñas en los que el recto se abre en un pequeño orificio estenótico anterior al centro del esfínter anal. Figura 2 ** **
La fístula recto vestibular
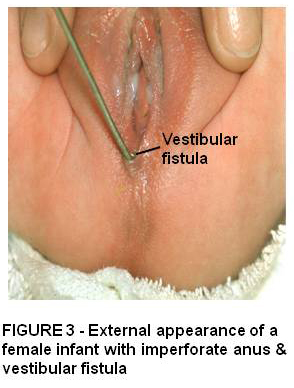
La fístula recto vestibular es el defecto más común que se observa en las niñas donde el recto se abre en el vestíbulo, que es el espacio entre el himen y la piel perineal. La mayoría tienen un buen sacro y un mecanismo esfínter anal. Figura 3
La fístula recto uretral
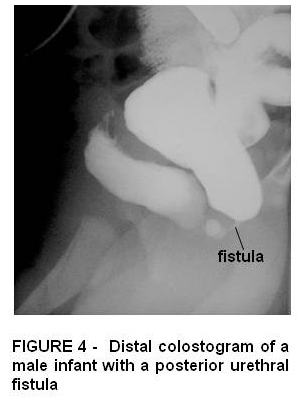
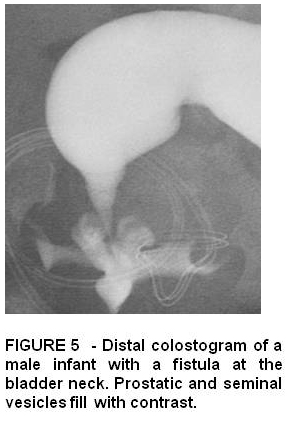
La fístula recto uretral es el defecto más frecuente en los varones. Existen 2 tipos: bulbar donde la uretra se abre en la uretra posterior inferior (bulbar) y la fístula prostática se abre más arriba dentro de la uretra prostática. Este último tiene una mayor incidencia de displasia sacra y musculatura pobre del esfínter anal. Figura 4 y Figura 5.
La fístula recto vesical
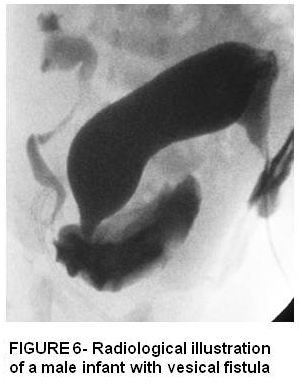
La fístula recto vesical es el defecto más alto o grave en los hombres donde la mayoría de los pacientes tienen displasia sacra, musculatura anormal del piso pélvico y esfínteres anales. La reparación quirúrgica generalmente implica abordaje sagital abdominal y posterior. Figura 6
El ano imperforado sin fístula
El ano imperforado sin fístula es raro, ya que el recto se encuentra generalmente a 2 cm por encima de la piel perineal. Estos pacientes suelen tener un buen sacro y buenos músculos del esfínter anal.
La cloaca
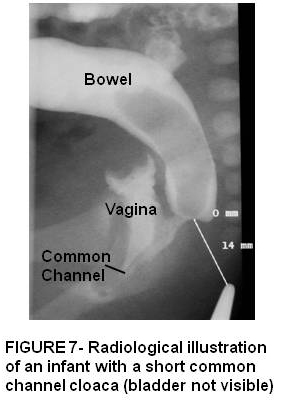
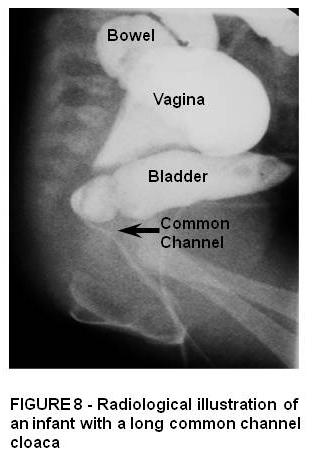
La cloaca es el extremo más grave del espectro de malformaciones ano rectales en las mujeres en las que la orina, genitales y el recto drenan a través de un canal común y una sola abertura perineal. Existe una alta incidencia de defectos sacros y urinarios asociados. Aquellos con un canal común corto <3 cm se pueden reparar con un abordaje sagital posterior. Sin embargo, aquellos con un canal cloacal común largo representan un defecto más complejo que generalmente requerirá una combinación de abdomen y sagital posterior. Figuras 7 y 8
ANOMALÍAS CONGÉNITAS ASOCIADAS
La incidencia de anomalías asociadas en pacientes con MRA puede llegar al 60%, siendo el tracto genitourinario y la columna vertebral afectados con mayor frecuencia 6,15,40-45.
ANORMALIDADES VERTEBRALES Y ESPINALES
Existe un amplio espectro de anomalías de la columna lumbar y sacra asociadas a pacientes con MRA, que van desde una hipoplasia leve hasta una ausencia completa de vértebras46,47. La coexistencia de defectos espinales, genitourinarios y ano rectales juntos representa un defecto regional o síndrome de regresión caudal. Estas anomalías ocurren con un patrón aleatorio y con diferentes grados de severidad 42,48.
La hipoplasia sacra, especialmente si es leve, puede pasar desapercibida ya que el defecto sacro produce poca deformidad externa. Los únicos signos físicos visibles son el aplanamiento y la asimetría de los glúteos y el desarrollo deficiente de la hendidura inter glútea 49. Por lo general, no hay defectos sensitivos y la función motora es normal, exceptuando a la musculatura del piso pélvico. Más adelante en la vida, la disfunción vesical e intestinal pueden ser el único signo, por lo que muchas veces pasa desapercibido y no es tratado en edades tempranas. En pacientes con malformación ano rectal, la presencia de una anomalía sacra también afecta el resultado funcional de la continencia fecal 1. Los pacientes con hipoplasia sacra, hemivertebra o vértebras fusionadas tienen un resultado mucho peor que los que tienen un sacro normal 36, 50.
Se ha pensado que el déficit neurológico en los pacientes con ARM son resultado del desarrollo defectuoso de las raíces nerviosas sacra. Muchos investigadores han observado una alta prevalencia de anomalías de la médula espinal cuando hay evidencia radiográfica de una anomalía sacra 47,51,52. En bebés menores de 3 meses de edad, una ecografía espinal es eficaz para evaluar anomalías de la médula espinal y se utiliza con frecuencia como herramienta de detección 53. La aparición de la imagen de resonancia magnética (RMN) ha permitido la evaluación no invasiva de la médula espinal en pacientes mayores. La incidencia de anomalías de la médula espinal oscila entre 24%50 y 50%54. La prevalencia de anomalías de la médula espinal es mayor en las ARM más graves y en aquellas con anomalías urogenitales.
CARDIACAS
Las malformaciones cardiovasculares ocurren en 12-22% de los pacientes con ARM 2, 29 . Las lesiones más comunes son la tetralogía de Fallot y los defectos del tabique ventricular. Se ha informado la transposición de las grandes arterias y el síndrome del corazón izquierdo hipoplásico, pero son poco frecuentes 29 .
ATRESIA ESOFÁGICA
Muchas malformaciones gastrointestinales se han descrito en asociación con el ano imperforado. Hasta el 10% de los pacientes tienen anomalías traqueo esofágicas. En un pequeño porcentaje de pacientes puede existir obstrucción duodenal debida a páncreas anular o atresia duodenal. También se ha descrito mal rotación con bandas de Ladd que causan obstrucción intestinal. La enfermedad de Hirschsprung se ha descrito en asociación con el ano imperforado, aunque se desconoce la incidencia de esta afección combinada 29, 30.
TRACTO GENITOURINARIO
Las anomalías genitourinarias ocurren con frecuencia en pacientes con MRA con una incidencia entre 20 a 50% 1,6,15,41,42.La importancia de investigar y tratar el tracto urinario en pacientes que nacen con malformaciones ano rectales ha sido recientemente enfatizada 56. En general, aproximadamente el 40% de los pacientes tiene una anomalía del tracto urinario y el 10% tiene una anomalía genital1,6,15, 44, 57
Tabla 2
| NIVEL DE FISTULA Malformación genitourinaria asociada (%) |
|---|
| Cloaca 88% |
| Cuello vesical 92% |
| Uretra prostática 66% |
| Uretra bulbar 25% |
| Vestibular 30% |
| Sin fístula 25% |
| Perineal 0% |
Las fístulas entre el ano recto y el tracto urogenital son el problema más frecuente y ocurren en el 95% de los pacientes 1, 6. La mayoría de los pacientes con fístula requieren una colostomía de desviación dentro de los primeros días de vida antes de la cirugía reconstructiva58. Las anomalías del tracto urinario pueden Influir significativamente en el resultado clínico de estos pacientes 6,40. Las anomalías del tracto urinario superior pueden ser responsables de insuficiencia renal primaria en pacientes con displasia o agenesia renal y se puede desarrollar insuficiencia renal secundaria en pacientes con anomalías no detectadas, como obstrucción de la unión pielo ureteral y/o obstrucción de la unión uretero vesical 57. En una serie de Toronto, el 14% de Los pacientes con ARM se presentaron con anomalías renales bilaterales 6.
La incidencia de anomalías urinarias aumenta de acuerdo con la gravedad de la ARM 10,44, 59. Rich y Pena notaron una estrecha correlación entre el nivel de la fístula rectal y la frecuencia y la gravedad de la malformación urológica asociada 15. En malformaciones altas, como cloaca y fístula del cuello de la vejiga hubo una incidencia del 90% de anomalías genitourinarias mientras que hubo una incidencia del 14% en anomalías bajas 57. También se ha sugerido que las personas con una anormalidad ósea lumbosacra o una anomalía genital tienen un mayor riesgo de anomalía renal asociada 15, 44.
La tasa de mortalidad por insuficiencia renal en pacientes con ARM es del 6% 6, por lo que no se puede minimizar la importancia de la evaluación urológica en todos los recién nacidos con ARM. Entonces, se pueden evitar complicaciones comunes y prevenibles. El seguimiento continuo a largo plazo es obligatorio controlar el tracto urinario superior y también excluir la vejiga neurogénica.
ANOMALIAS GENITALES
Son muy comunes en pacientes con MRA. En una serie, el 52% de los niños presentaba anomalías genitales, como hipospadias, escroto bífido, testículos bilaterales no descendidos o transposición penoscrotal 6. La presencia de una anomalía genital en niños con MRA parece tener mayor asociación con anomalías renales. La criptorquidia es un hallazgo común y la incidencia varía entre el 10 y el 40% de los pacientes masculinos con MRA 6,44,57. McLorie informa que esto es más común en malformaciones altas versus bajas (27% frente a 7%). Se ha descrito anomalías en el pene en 14 a 25% de los pacientes con ARM masculinos 44,57. La hipospadias es la anomalía del pene más comúnmente detectada, pero también se han descrito casos de curvatura, epispadias y duplicación del pene en algunos pacientes 44. Un escroto bífido ocurre con frecuencia y, a menudo, también se ha descrito con las variantes más graves de hipospadias y transposición penoscrotal. 6
Las anormalidades mullerianas ocurren en 30 a 45% de las niñas con ARM 55,60,61. Las anomalías de la cloaca se caracterizan por la confluencia de la uretra, la vagina y el recto en un solo canal, o cloaca persistente con una abertura solitaria en el perineo 62. Esta anomalía se produce como resultado de un defecto complejo del desarrollo perineal, y se asocia con mal desarrollo del tubérculo mulleriano, bulbos sinovaginales, placa vaginal y seno urogenital. Las anomalías resultantes muestran una gran variación dependiendo de si la confluencia es alta o baja 57,62. Un cierto grado de septación del útero y la vagina, que va desde un tabique parcial en una vagina con cuello uterino y útero únicos, hasta una vagina doble completamente separada con doble cuello uterino y útero, se observa en el 60% de los pacientes con cloaca 10,57,62, 63. Las anomalías de los genitales externos en niñas son raras, pero se han descrito la ocurrencia de hemangiomas y/o hamartomas de los labios mayores.
Tabla 3. Anomalías urológicas diagnosticadas en 62 pacientes con ARM estudiados prospectivamente
| Anormalidad urológica | numero | % | |
| — | — | — | |
| Displasia renal | 8 | 13% | |
| Riñón solitario | 4 | 6% | |
| Hidronefrosis congénita | 5 | 8% | |
| Dúplex | 4 | 6% | |
| Herradura | 1 | 2% | |
| Displasia multiquística | 4 | 6% | |
| Fusión cruzada | 1 | 2% | |
| Uraco persistente | 2 | 3% | |
| Reflujo vésico ureteral | 16 | 26% | |
| Atresia de vejiga | 2 | 3% | |
| Válvulas uretrales posteriores | 1 | 2% | |
RECONSTRUCCION QUIRURGICA
Los informes de ausencia de ano se documentaron en la época grecorromana y Soranos de Éfeso fue el primero en describir la rotura de una membrana anal en forma digital 36. Desde el siglo quince hasta el siglo dieciocho aparecieron numerosos informes y el tratamientos, básicamente mediante la perforación ciega del perineo con un trocar 64, 65. Bodenhamer en 1860 hizo una clara distinción entre anomalías baja (anal) y alta (rectal). 65. A fines del siglo XIX, se desarrollaron abordajes perineales y sacro perineales que involucraban la disección anatómica de la bolsa rectal en lugar de una punción ciega 66,67. Sin embargo, la mortalidad quirúrgica era entre un 40% al 90% a principios del siglo XX 68,69. Las malformaciones cloacales durante muchos años se llamaron ano imperforado con seno urogenital 70. Por lo tanto, el paciente generalmente tenía tratamiento quirúrgico para el ano imperforado y la porción del seno urogenital no se trataría hasta una fecha posterior. Es solo en los últimos 30 años que el tratamiento quirúrgico de la cloaca ha evolucionado y esto coincidió con una nueva comprensión de las anomalías ano rectales y el desarrollo de nuevas técnicas quirúrgicas71.
Históricamente, el abordaje quirúrgico de las malformaciones ano rectales fue bastante empírico. Los defectos bajos se trataron mediante operaciones perineales simples, sin embargo, los defectos altos más complejos, donde el recto estaba a más de 1 cm de la piel, la mayoría de los cirujanos optaban por una reparación abdominoperineal tirando el recto desde posterior en un intento por evitar lesiones en las estructuras urogenitales 36. Stephens, con su estudio científico pionero de estos defectos en la década de 1960, sugirió que era importante preservar una parte importante del músculo elevador, el puborrectal 37, 69, que incluía la colocación del recto cerca de la uretra y la vagina y la disección mediante la combinación de un abordaje sacro y perineal. Sin embargo, este procedimiento implica un paso ciego que generalmente está relacionado con un área crucial alrededor del cuello de la vejiga, la uretra posterior, vesículas seminales y deferente. Teniendo en cuenta que tanto la uretra posterior como la vagina posterior comparten una pared común con el recto y es difícil separar una de la otra, incluso bajo visión directa, esto podría explicar algunas de las complicaciones postoperatorias encontradas con esta técnica 68. La anorectoplastía sagital posterior (PSARP) 71,72 descrita por Peña y de Vries en 1982 y permite al cirujano la exposición directa de la anatomía de la malformación ano rectal con excelentes visión de la fístula en la mayoría de los casos. Esto reduce significativamente el riesgo de daño iatrogénico a estructuras pélvicas importantes 10.
Manejo del recién nacido
Cuando nace un niño con ARM, el examen clínico del perineo arroja pistas importantes sobre el nivel de manejo. Luego se podrán tomar decisiones sobre el tratamiento quirúrgico. Si es posible, es importante esperar 24 horas antes de decidir si es necesaria una colostomía, ya que puede tomar tiempo para que se acumule suficiente presión dentro del recto y para que el meconio drene a través de una fístula. El meconio puede drenar directamente en el perineo o a través del chorro urinario en bebés con fístula del tracto urinario. El examen clínico también permite la inspección del sistema cardiovascular, la columna vertebral y los genitales para detectar anomalías asociadas.
En las primeras 48 horas, es habitual que el niño reciba líquidos por vía intravenosa y antibióticos por vía intravenosa. Una sonda nasogástrica es esencial para descomprimir el intestino y también excluirá la presencia de atresia esofágica. Un ecocardiograma es esencial para detectar defectos cardíacos estructurales antes de la anestesia general. Algunos autores recomiendan una radiografía simple especialmente en la posición lateral para ayudar a determinar el nivel del defecto 10. El ultrasonido es una forma confiable y no invasiva de visualizar el tracto urinario y la columna vertebral en un momento conveniente.
En lactantes con fístula perineal es frecuente realizar una anoplastia en las primeras 48 horas de vida 9,10. Para el resto de los defectos, se diseña una colostomía protectora para descomprimir el intestino y luego se puede planificar la cirugía definitiva cuando el bebé sea mayor y se confirme la anatomía del defecto. Algunas instituciones pueden optar por realizar una reparación neonatal sin colostomía, pero esto no se recomienda a menos que el cirujano tenga amplia experiencia en este campo 9,10, 36. Una colostomía se puede realizar con baja morbilidad incluso en un bebé enfermo o prematuro. Se prefiere una colostomía a caños separados que una en asa, ya que evita el paso de deposiciones en el colon distal. La mayoría de los cirujanos colocan el estoma en el sigmoides proximal o en el colon descendente, ya que esto deja una longitud adecuada del colon distal para la movilización del recto durante el procedimiento de descenso 36,58 . Una vez que se realiza el ostoma, el bebé puede alimentarse normalmente y crecer. Luego se puede realizar un colograma distal que es esencial para detectar el nivel de la fístula en el tracto urinario y planificar la cirugía reconstructiva. Un estoma también tiene el beneficio de proteger la reparación definitiva hasta que el área haya cicatrizado. 10, 58
En niñas con cloaca persistente, es útil realizar una endoscopia, en el momento de la formación de la colostomía, para evaluar la anatomía interna y determinar la longitud del canal cloacal común. En algunos pacientes con cloaca también puede ser necesario crear un drenaje más efectivo del tracto urinario 73.
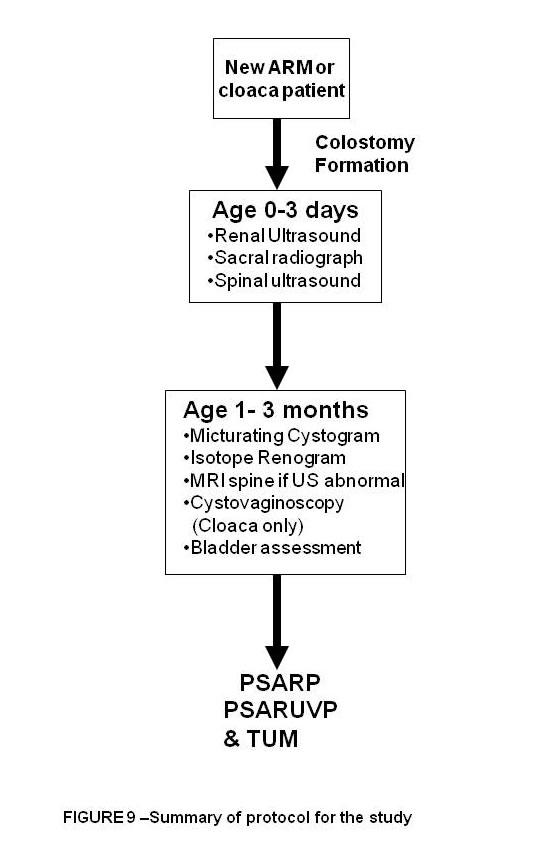
Figura 9. Resume el plan de tratamiento para un recién nacido ARM
REPARACIÓN QUIRÚRGICA DEFINITIVA
Aunque se han descrito muchas reparaciones en el pasado, la mayoría de los cirujanos ahora usan el enfoque sagital posterior para reparar malformaciones ano rectales con o sin laparotomía o laparoscopia. La reparación se realiza con mayor frecuencia en alrededor de 2 a 4 meses, pero esto depende de la práctica local y del estado clínico del paciente.
LA ANORECTOPLASTIA SAGITAL POSTERIOR (PSARP)
La PSARP comienza abriendo el área entre el sacro medio y el esfínter externo a través de una incisión sagital en la línea media con el paciente en la posición prona. El sitio apropiado para el ano es determinado por un electro estimulador. Todas las estructuras musculares se separan precisamente en la línea media. Se moviliza el intestino, se abre y se identifica la fístula. Luego, la fístula se divide, se liga y el intestino se separa meticulosamente del tracto urinario o la vagina. Luego, el cirujano debe diseccionar el intestino para obtener la longitud suficiente para suturarlo a la piel. El complejo muscular dividido de forma sagital, que incluye el elevador y el esfínter externo, se vuelven a aproximar dorsalmente al intestino y la capa muscular del intestino se sutura circunferencialmente al esfínter externo circundante para crear un neo ano 71,72.
Este enfoque permite la visualización directa de la anatomía y le brinda al cirujano la mejor oportunidad para preservar estructuras anatómicas importantes, como la uretra, la vagina, la próstata, el deferente, las vesículas seminales y los nervios necesarios para el control urinario y la función sexual. La parte más importante de la operación está representada por la separación del recto de las estructuras genitourinarias. La mayoría de las veces hay una pared común sin plano natural de disección por lo que pueden aparecer complicaciones tardías en la adolescencia tales como estenosis uretrales, incontinencia urinaria e impotencia sexual 74.
PROCEDIMIENTO LAPAROSCÓPICO
Los objetivos del descenso laparoscópico incluyen permitir la colocación precisa del recto a través de los esfínteres externos sin dividir el complejo del esfínter y disminuir la cicatrización peri rectal 75. La laparoscopia y la disección subsiguiente proporcionan una buena exposición a las fístulas del cuello uretral y vesical. Luego, la fístula se puede dividir por ligaduras antes de la división 75. La disección transperineal se realiza una vez que los esfínteres se han mapeado externamente utilizando un electro estimulador. Después de la disección apropiada, se introduce un trocar desde abajo con visión directa mediante un laparoscopio. Luego, el recto se desciende sobre el perineo, lo que permite la anastomosis externa 75.
LAS VARIANTES DE PSARP PARA LA REPARACIÓN DE CLOACA
La reconstrucción quirúrgica más desafiante en el espectro de la ARM es la de la cloaca persistente que involucra la corrección del defecto urogenital además del descenso ano rectal. Los defectos inferiores con un canal común corto son susceptibles de ser reparados por el abordaje sagital o perineal posterior; sin embargo, los que tienen un canal común largo son mucho más complejos y continúan siendo un desafío para el cirujano. Tradicionalmente, el enfoque consistía en reparar el componente rectal y dejar el componente urogenital hasta una fecha posterior 76. Hendren y Peña abogan por la reparación simultánea de los 3 componentes mediante abordaje sagital abdominoperineal 77,78.
Vagino anorecto uretero plastia sagital posterior (PSARVUP)
Usando la anorecto vaginouretroplastia sagital posterior (PSARVUP), la cloaca se puede reparar mediante la separación completa de las tres estructuras 77. Tal como se describe en la sección anterior, el recto se identifica por un abordaje sagital posterior y se disecciona de la vagina. Luego, la pared vaginal anterior se diseca meticulosamente del tracto urinario y tanto el recto como la vagina se movilizan desde abajo (y más arriba donde sea necesario) antes de colocarlos en sus posiciones normales. El canal común anterior se usa para crear una neouretra 77. En los casos de un canal común largo, la vagina puede ser demasiado corta como para que la anastomosis llegue al perineo, por lo que se tienen que usar colgajos de piel adicionales o reemplazo intestinal para crear una vagina 79.
MOVILIZACIÓN UROGENITAL TOTAL
En 1997, Peña describió la técnica de movilización urogenital total para la reparación de malformaciones cloacales. Esta maniobra quirúrgica ha reducido considerablemente el tiempo operatorio y ha simplificado el procedimiento. En esta modificación, el recto se separa de la vagina a través del abordaje sagital posterior y luego se disecciona todo el seno urogenital y se moviliza en bloque 80. La disección avanza lateralmente y en sentido anterior a la uretra y la vagina de manera circunferencial. Los ligamentos a vasculares que sujetan la uretra y la vagina al borde pélvico se dividen y la disección continúa alrededor de la vagina, la pared anterior de la vejiga y la uretra hasta que se ha ganado la longitud suficiente para conectar los bordes vaginales y la uretra al perineo 80. En casos de un canal cloacal común largo, un abordaje abdominal combinado puede ser necesario. Esta técnica también se ha usado para la reparación de un seno urogenital persistente 81-83.
CIRUGIA REDO
Hay 2 indicaciones principales para la cirugía de rehacer: control funcional deficiente o complicación postoperatoria, como fuga, fístula recurrente o prolapso rectal 10,84. Los candidatos para el segundo PSARP deben tener un recto mal posicionado. El abordaje transrectal sagital posterior también se puede usar cuando se corrige la cloaca mal diagnosticada con un seno urogenital no movilizado. 84
RESULTADOS
Continencia fecal
Los niños con ARM tienen una anormalidad de desarrollo estructural compleja. Mientras que la intervención quirúrgica tiene como objetivo corregir la malformación, la mayoría de los pacientes que se someten a cirugía tienen algún grado de trastorno funcional de la defecación. La continencia fecal depende de tres factores principales: esfínteres, sensación y motilidad. La mayoría de los pacientes con malformación ano rectal tienen una alteración de este mecanismo de motilidad intestinal. 85 La continencia se define como los movimientos intestinales voluntarios con un mínimo de suciedad. Las tasas de continencia varían según la anatomía presente y las malformaciones asociadas. Una médula espinal anclada u otra malformación espinal, como la hemivertebra o el disrafismo espinal, puede aumentar significativamente el riesgo de incontinencia 9,10,86. Las complicaciones quirúrgicas también disminuyen las posibilidades de continencia primaria, aunque esto es difícil de cuantificar. La re operación reduce significativamente la posibilidad de continencia 84,86. La continencia total varía según el tipo de ARM y ha sido reportada en un 90% en las fístulas perineales, un 70% en las fístulas recto vestibulares, un 50% en las bulbares, un 30% en las prostáticas, en un 27% en cloaca con canal común largo y en un 12% en fístula al cuello vesical 9,10,85,86. La distensión del recto parece ser percibida por muchos de estos pacientes, siempre que el recto se haya ubicado con precisión dentro de las estructuras musculares. Esta sensación parece ser una consecuencia del estiramiento del músculo voluntario (propiocepción). La implicancia clínica más importante de esto es que el paciente con malformaciones ano rectales puede no sentir heces líquidas o material fecal blando, ya que el recto no está distendido 86. Por lo tanto, para lograr cierto grado de sensación y control intestinal, el paciente debe tener la capacidad de formar heces sólidas. La motilidad intestinal es quizás el factor más importante en la continencia fecal.
El estreñimiento es un problema muy frecuente en pacientes con ARM con una incidencia de 22-68% 10, 36, 85. Un colon hipo peristáltico distendido eventualmente conduce a un estreñimiento más grave (Mega recto). 9,85 El recto sigmoides enormemente dilatado se comporta como en un tipo de trastorno de hipo motilidad miopática, pero tiene células ganglionares normales en la biopsia. Los pacientes con incontinencia fecal que tienen estreñimiento pueden ser tratados con enemas 36,69,86. En algunos pacientes con complejo muscular deficiente o resección colónica, no tienen reservorio rectal y con frecuencia pierden heces. Esta es una situación equivalente a una colostomía perineal 88. En estos casos, el tratamiento médico consiste en enemas más una dieta estreñida y medicamentos para disminuir la motilidad colónica 10,86.
La mejor determinación para la continencia futura es la observación de la función a medida que el niño crece y madura. Un niño que fuga constantemente las heces probablemente no mejorará para la edad escolar y puede beneficiarse de un tratamiento intestinal temprano. Sin embargo, si un niño es capaz de mantener las heces, es mejor observar que el niño desarrolla la función intestinal. Independientemente de lo que el niño será capaz de hacer en el futuro, es importante establecer un régimen de manejo intestinal que la familia o el niño puedan enfrentar de manera independiente.
Renal
No hay estudios que informen la función renal en cohortes prospectivas de pacientes con ARM. Sin embargo, Misra describió a 4 de 95 pacientes con insuficiencia renal crónica; El diagnóstico subyacente fue displasia renal bilateral, reflujo vesicouretérico bilateral y vejiga neuropática. Los pacientes con insuficiencia renal crónica (definida como una tasa de filtración glomerular, GFR, corregida para el área de superficie, de menos de 80 ml / min) se han descrito en anomalías tanto altas como bajas. Un paciente requirió trasplante renal antes de los 18 años. 87. La incidencia de insuficiencia renal crónica en pacientes con lesiones altas no está bien documentada, pero entre el 2 y el 6% de estos pacientes mueren por insuficiencia renal, en comparación con el 1.1% con lesiones bajas 6 . El manejo de la insuficiencia renal crónica y la enfermedad terminal en niños con ARM plantea desafíos específicos. La diálisis peritoneal y el posterior trasplante renal pueden ser difíciles debido a las operaciones abdominales anteriores. Además, los pacientes que pasan al trasplante renal necesitan una evaluación cuidadosa para excluir la vejiga neuropática, lo que podría continuar comprometiendo el nuevo riñón. 57
Continencia urinaria
La etiología de la disfunción del tracto urinario inferior en la ARM y las anomalías cloacales es poco conocida 50. Sin embargo, la disfunción de la vejiga causa morbilidad urológica significativa en la población pediátrica, lo que resulta en daño renal debido a infecciones recurrentes del tracto urinario e incontinencia urinaria, las cuales pueden causar morbilidad profunda y discapacidad 88. La infección urinaria recurrente puede pasarse por alto o atribuirse a un reflujo vesicouretérico coexistente o anomalías renales, que prevalecen en una alta proporción de estos niños 6,88. En consecuencia, la detección de disfunción vesical a una edad temprana es esencial para evitar el deterioro de la función renal 56, 88,89.
La incidencia general de disfunción de la vejiga según lo evaluado por la urodinámica se ha reportado entre el 7 y el 30% 90, 91. La mayoría de los niños con disfunción de la vejiga tenían una columna vertebral o médula espinal anormal 92. Esto fue confirmado por Warne, quien prospectivamente estudió un grupo de 45 pacientes con ARM por urodinámica de llenado natural y encontraron que el 58% de los pacientes con ARM y el 83% de los pacientes con cloaca tenían disfunción de la vejiga 90.
A diferencia de la incontinencia fecal, la incontinencia urinaria impacta en los riñones. La incontinencia causada por una vejiga neurogénica puede estar asociada a infecciones recurrentes del tracto urinario y reflujo vesicouretérico. Esta combinación puede causar daño continuo a los riñones, lo que resulta en insuficiencia renal 6,93. En consecuencia, el manejo agresivo temprano de estos pacientes es importante para prevenir el daño renal. Los factores importantes son asegurar que la vejiga se vacíe regularmente y que la presión intravesical permanezca baja. El vaciado de la vejiga, cuando es necesario, se realiza con un cateterismo intermitente limpio (CIC). El CIC puede realizarse uretralmente o mediante un estoma de Mitrofanoff 88. En la mayoría de los pacientes con una ARM, la uretra es sensible, por lo que la CIC uretral puede ser incómodo, especialmente en el paciente de mayor edad.
Resultados adultos - Función sexual y psicología
Con técnicas quirúrgicas mejoradas, estos niños tienen vidas relativamente normales con una buena esperanza de vida. La literatura pediátrica tiende a concentrarse en los resultados de la continencia, pero a medida que estos pacientes alcanzan la adolescencia y la edad adulta, la función psicosocial y sexual también se vuelve importante.
Hombres
La función sexual disminuida se ha notificado en pacientes varones adultos que se han sometido a procedimientos quirúrgicos en el área prostática en el momento de la anoplastia 94. La fertilidad siempre se ha informado en términos de paternidad y la literatura para este grupo es escasa. La subfertilidad puede ser multifactorial y debido a criptorquidia, anomalías genitales, anomalías sacras o lesiones iatrogénicas 94. Holt et al, que investigaron a 20 pacientes adultos con ARM por infertilidad, encontraron que la lesión iatrogénica en la cirugía del descenso representaba la mitad de los casos 95.
Mujeres
En la adolescencia es importante evaluar a las mujeres nacidas con ARM. Levitt informa que el 10% de las niñas con fístula rectovestibular en la serie de Peña tenían atresia vaginal 96. Otro 7% tenía un tabique vaginal que requería intervención quirúrgica 96. Esto resalta la importancia de reevaluar a todas las pacientes con cloaca y ARM femeninas antes de la aparición de la menstruación para evitar las complicaciones. Todos los pacientes con cloaca se han sometido a algún tipo de reconstrucción vaginal y una revisión de 21 pacientes adultos mostró que el 86% tenía una vagina adecuada y no tenía dificultades menstruales y el 57% era sexualmente activo 62. Hay informes de casos en la literatura de embarazo normal y parto vaginal en pacientes con MRA 97.
Psicología
En algunas publicaciones, los resultados intestinales y urinarios en adultos parecen ser peores a lo sugerido en los informes pediátricos, con altos niveles de incontinencia tanto urinaria como fecal 98. Una ARM alta se asocia con un mayor grado de incontinencia. Tanto los hombres como las mujeres obtuvieron puntuaciones más bajas que los controles sobre la estima corporal, el bienestar sexual y las evaluaciones de la calidad de vida. La incontinencia urinaria e intestinal se asoció con un bienestar sexual más pobre 98. Por lo tanto, es importante que los futuros pacientes con ARM tengan atención multidisciplinaria durante esta transición de la niñez a la edad adulta. En esta etapa, se pueden abordar las preocupaciones sobre la función sexual y el bienestar que son fundamentales para una calidad de vida aceptable.
CONCLUSIÓN
El tratamiento de las malformaciones ano rectales requiere un diagnóstico preciso en el momento de la presentación, un manejo neonatal correcto con anoplastia primaria o colostomía des funcionalizante junto con el tratamiento de las malformaciones asociadas.
Una reconstrucción anatómica en el momento adecuado es vital. Postoperatoriamente, el tratamiento debe ser multidisciplinario. Si el niño no alcanza la continencia normal, entonces la intervención temprana por medio de los programas de manejo de la vejiga y los intestinos es fundamental y conduce a un niño limpio y seco con una excelente calidad de vida, porque posee la capacidad de continencia o puede ser mantenido artificialmente limpio. El seguimiento a largo plazo de estos pacientes en la adolescencia y la edad adulta es importante para tratar los problemas que puedan surgir y apoyar psicológicamente al paciente a medida que se desarrolla.
Referencias
- Peña A., malformaciones ano rectales. Semin Pediatr Surg. 4: 35-47, 1995.
- Rowe, MI Malformaciones anorectales en aspectos esenciales de la cirugía pediátrica. 1ª ed., Mosby, 1995: 596-609.
- Hendren, WH: Aspectos urológicos de malformaciones cloacales. J. Urol., 140: 1207-1213, 1988.
- Brock, WA, Pena A. Cloacal Anormalidades y Imperforado ano. En: Clínica de Urología Pediátrica, 3ª edición, Editado por PP Kelais, LR King, AB Belman, WB Saunders, 1992. Vol 2 chapt 19: 920-942.
- Jones, K .: Patrones reconocibles de Smith de malformaciones humanas, 5ª ed. Filadelfia, WB Saunders; 492-495 de 1997.
- McLorie, G., Sheldon, M., Fleisher, M. y otros: El sistema genitourinario en pacientes con ano imperforado. J. Pediatr. Surg., 22: 1100-1104, 1987.
- RM de invierno, Baraitser M. London Dysmorphology Database. Oxford University Press, 2000.
- Quan L, Smith DW: La asociación Vater. J Pedaitr. 82; 104-108, 1973.
- Pena, A. Manejo quirúrgico de malformaciones anorrectales: un concepto unificado. Pediatr Surg Int. 3: 82-93, 1988.
- Pena A., Hong A. Avances en el manejo de malformaciones anorectales. Soy J Surg. 180: 370-376, 2000.
- Maizels M., Simpson S. Conductos primitivos de displasia renal inducidos por el cultivo de brotes ureterales desnudos de mesénquima renal condensada. Ciencia; 219: 509-510, 1983.
- Warne S., Wilcox DT, Chitty L .: Diagnóstico prenatal de anomalías de la cloaca. BJU Int; 89: 78-81, 2002.
- Beck, D. El efecto de la obstrucción urinaria intrauterina sobre el desarrollo del riñón fetal. J. Urol; 105: 784-789 1971.
- Zaccara A., Gatti C., Silveri M. y otros. Cloaca persistente ¿Estamos listos para un correcto diagnóstico? Urología; 54: 367, 1999.
- Rich M., Brock W., Pena A. El espectro de malformaciones urinarias genitológicas en pacientes con malformaciones cloacales. Pediatr Surg Int; 3: 110-113, 1988.
- Moore K. The Developing Human: embriología con orientación clínica, tercera edición. Filadelfia, WB Saunders, 1983: p262.
- Van der putte SC Desarrollo normal y anormal del anorecto. J Pediat Surg; 21: 434-40, 1987.
- Qi B., Williams A. Aclaración del proceso de separación de la cloaca en el recto y el seno urogenital en el embrión de rata. J Pediatr Surg; 35: 1810-16, 2000.
- Qi B., Beasley S. ¿Se fusiona el tabique urorrectal con la membrana de Cloacal? J Urol; 164: 2070-72, 2000.
- Penington EC, Hutson JM La ausencia de fusión lateral en la partición cloacal. J Pediatr Surg; 38: 1287-95, 2003.
- Kluth D., Hillen M., Lambrect W. Los principios del desarrollo normal y anormal de Hindgut. J Pediatr Surg; 30: 1143-47, 1995.
- Ikebukoro K., Ohkawa H. Análisis tridimensional de la embriología anorrectal. Pediatr Surg Int; 9: 2-7, 1994.
- Liang X., Ioffe O., Sol C. Secuencia Disgenesia Cloacal. Pediatr Dev Pathol; 1: 281-288, 1998
- Martinez-Friaz ML, VACTERL como defectos de campo de desarrollo politópicos primarios. Am J Genet; 83: 13-16, 1999
- Ratan SK, Rattan KN et al. Anomalías congénitas asociadas en pacientes con malformaciones anorrectales. J Pediatr Surg 39: 1706-1711, 2004
- Lerone M, Bolino A, Martuccielo G. La genética de las malformaciones anorrectales: un asunto complejo. Semin Pediatr Surg 6: 170-179, 1997
- Mo R, Kim JH, Zhang J et al. Malformaciones anorrectales causadas por defectos en la señalización del erizo sónico. Am J Pathol 159: 765-774, 2001.
- Ionnaides AS, Henderson DJ, Spitz L. El papel del erizo sonoro en el desarrollo de la tráquea y el esófago. J Pediatr Surg 38: 29-36, 2003
- Cuschieri A; Grupo de trabajo EUROCAT: anomalías anorrectales asociadas con o como parte de otras anomalías. Am J Genet; 110: 122-130, 2002.
- Martuccielo G. Genética de las malformaciones anorrectales Capítulo 2 En Malformaciones anorrectales en niños, 17-30. Springer-Verlag, 2006
- Reardon W, Zhou XP, Eng C. Una nueva mutación de la línea germinal del gen PTEN en un paciente con macrocefalia, dilatación ventricular y características de la asociación VATER. J Med Genet 38: 820-823, 2001.
- Duhamel B, de la sirena a la imperforación anal: el síndrome de regresión caudal. Arch Dis Child 36: 152-155, 1961
- Wilmhurst J., Kelly R., Boryzykowski M. Presentación y resultados de la agenesia sacra: la experiencia de 20 años. Medicina del Desarrollo y Neurología Infantil; 41: 806-812, 1999
- Currarino G, Coln D, Votteler T. Tríada de anomalías anorrectales, sacras y presacras. AJR Am J Roentgenol 137: 395-398, 1981
- Hagan DM, Ross AJ, et al. Análisis de mutaciones y embriones del gen del síndrome HLXB9Currarino. AmJ hum Genet 66: 1504-1515, 2000
- Rintala RJ, malformaciones anorrectales: descripción general en cirugía pediátrica y urología: resultados a largo plazo. WB Saunders Ltd, 1998 Capítulo 30a: 357-375.
- Stephens FD, Smith ED. Malformaciones anorrectales en niños. Chicago Anuario médico 1971.
- Stephens, FD y Smith, ED: Clasificación, identificación y evaluación del tratamiento quirúrgico de las anomalías anorrectales. Pediatr. Surg. Int., 1: 200, 1986.
- Pena, A .: Atlas de Manejo Quirúrgico de Malformaciones Anorectales. Nueva York: Springer-Verlag, 1990: 49-55.
- Sheldon CA, Gilbert A., Lewis AG, Aiken J., Ziegler MM. Implicaciones quirúrgicas de las anomalías del tracto genitourinario en pacientes con ano imperforado. J Urol; 152 : 196-199, 1994.
- Williams DI, Grant J. Complicaciones urológicas del ano imperforado. Br J Urol; 41: 660-665, 1969.
- Wiener ES, Kieswetter WB Anomalías urológicas asociadas con el ano imperforado. J Pediatr Surg; 8: 151-157, 1973.
- Parrott, TS: implicaciones urológicas de malformaciones anorrectales. Urol. Clinica N. Amer., 12: 13, 1985.
- Metts J., Kotkin K., Kasper S. y col. Malformaciones genitales y anomalías urinarias o vertebrales coexistentes en pacientes con ano imperforado. J Urol 158: 1298-1300,1997.
- Santulli T., Schullinger., Keisewetter et al. Ano imperforado: una encuesta realizada por miembros de la sección quirúrgica de la Academia Americana de Pediatría. J Pediatr Surg 6: 484, 1971.
- Columna vertebral, médula espinal y meninges. En Swischuk LE, Imaging of The Newborn Infant and Young Child, 4ª edición, Lipincott, Williams and Wilkins, 1997: 1020-1059.
- Carson J., Barnes P., Tunnell W. y col. Ano imperforado: la implicación neurológica de las anomalías sacras. J Pediatr Surg; 19: 838-842, 1984.
- Estin D., Cohen AR Agenesia caudal y malformaciones de la columna vertebral asociadas. Neurosurg Clin N Am .; 6: 377-391, 1995.
- Boemers TM. Consideraciones patógenas en disfunción del tracto urinario inferior en niños con malformaciones anorrectales Kononklijke Data 1998, Capítulo 3, p58.
- Levitt M., Patel M., Rodriguez G., Gaylin D. Pena A. La médula espinal atada en pacientes con malformaciones anorrectales. J Pediatr Surg; 32: 462-468, 1997.
- Pang D. Agenesia sacra y malformaciones de la médula espinal caudal. Neurocirugía; 32: 755-778, 1993.
- Tunell WP, Austin JC, Barnes PD, Reynolds A. Evaluación neurorradiológica de las anomalías sacras en el complejo del ano imperforado. J Pediatr Surg; 22: 58-61, 1987.
- Dick EA, Patel K., Owens CM, de Bruyn R. Ultrasonido espinal en bebés. Dr. J Radiol; 75: 384-892, 2002.
- Heij H., Nievelstein R., de Zwart I. et al .. Anatomía anormal de la región lumbosacra obtenida mediante resonancia magnética en niños con formas anorrectales Archiv Dis Child; 74: 441-444, 1996.
- Mollitt, DL, Schullinger JN, Santulli TV Comlications at menarche del seno urogenital con malformaciones anorrectales asociadas. J. Pediatr. Surg; 16: 349-352, 1981.
- Boemers T., Beek F., Bax, M. Problemas urológicos en malformaciones anorrectales: directrices para la detección y el tratamiento inicial (protocolo ARGUS) BJU .Int; 83: 662-671 1999.
- Wilcox DT, Warne SA. Problemas urológicos en niños con malformaciones anorrectales Capítulo 17 En malformaciones anorrectales en niños, 269-279. Springer-Verlag, 2006
- Wilkins S., Pena A. El papel de la colostomía en el tratamiento de las malformaciones anorrectales Stephens, Pediatr. Surg. En t. 3: 105-109, 1988.
- Rickwood AMK, Spitz L. Primary vesicouretericreflux en neonatos con ano imperforado. Arch Dis Child 55: 149–150, 1980
- Fleming S, Hall R, Gysler M, McLorie G Ano imperforado en mujeres: frecuencia de afectación del tracto genital.J Pediatr Surg 21: 146–150, 1986
- Hall JW, Fleming S, Gysler M, McLorie G (1985) El tracto genital en niñas con ano imperforado. Surg Gynecol Obstet 151: 169–171, 1985
- Warne SA, Wilcox DT, Creighton S, Ransley PG Resultado ginecológico a largo plazo de pacientes con cloaca persistente. J Urol 170: 1493-1496, 2003
- Levitt MA, Stein DM, Peña, A. Preocupaciones ginecológicas en el tratamiento de adolescentes con cloaca. J. Pediatr. Surg; 33: 188-193, 1998.
- Scharli, AF, Malformaciones del ano y recto y su tratamiento en la historia médica. Prog Ped Surg; 11; 141-172, 1978.
- Boenhamer WH, un tratado práctico sobre etiología, patología y tratamiento de las malformaciones congénitas del recto y del ano. Nueva York: madera, 1860.
- Ammussat JZ. Historia de una operación de un animal artificial, práctica, éxito, éxito, y un caso de ausencia. Gaz Med de Paris; 3: 753-764, 1835.
- Cripps H. El tratamiento del ano imperforado. Br Med J; 1: 1197-1198, 1892.
- Keisewetter W. Imperforate anus: el papel y los resultados del abordaje sacro-abdomen-perineal. Ann Surg; 164: 655-662, 1966.
- Stephens FD, Smith ED. Malformaciones anorrectales en niños. Chicago Anuario de Medicina, 1971
- Hendren WH Seno urogenital y malformación anorrectal: experiencia con 22 casos. J Pediatr Surg; 15: 628-641, 1980.
- De Vries PA, Pena A. Anorectoplastia sagital posterior. J Pediatr Surg; 17: 638-643, 1982.
- Pena A., De Vries PA Anorectoplastia sagital posterior: consideraciones técnicas importantes y nuevas aplicaciones. J Pediatr Surg; 17: 796-811, 1982.
- Warne SA, Wilcox DT, Ransley PG. Resultado urológico a largo plazo en pacientes con cloaca persistente. J Urol; 168: 1859-1862, 2002.
- Hong AR, Acuna MF, Peña A., et al. Lesiones urológicas asociadas con la reparación de malformaciones anorrectales en pacientes varones. J Pediatr Surg; 37: 339-344, 2002.
- Georgeson KE, Muensterer DO. Deslizamiento anorectal asistido por laparoscopia. Capítulo 23 En Malformaciones anorrectales en niños, 315-318. Springer-Verlag, 2006
- Hendren WH Seno urogenital y malformación anorrectal: experiencia con 22 casos. J Pediatr Surg; 15: 628-641, 1980.
- Pena A. El manejo quirúrgico de la cloaca persistente: resultados en 54 pacientes tratados con un abordaje sagital posterior. J. Pediatr. Surg. 24: 590-598, 1989.
- Hendren WH Cloaca, el grado más severo de ano imperforado. Ana. Surg; 228 (3): 331-346, 1998.
- Alexander F., Kay R. Consideraciones técnicas en la reparación de las deformidades vaginales de la cloaca. J Urol; 53: 788-791, 1995.
- Peña A .: Movilización urogenital total: una forma más fácil de reparar las cloacas. J Pediatr Surg; 32: 263-268, 1997.
- Ludwikowski B., Oesch I., Gonzalez R. Movilización total del seno urogenital: aplicaciones ampliadas. BJU Int. 83: 820-822, 1999.
- Rink R. Enfoque sagital posterior a la vagina alta, Dialog Pediatr Urol 21: 1-8, 1998.
- Pena A. Malformaciones anorrectales: nuevos aspectos relevantes para los cirujanos colorrectales adultos. Seminarios en Cirugía de Colon y Recto; 5: 78-88, 1994.
- Peña A, Grasshoff S, Levitt M. Reoperaciones en malformaciones anorrectales. J Pediatr Surg. Feb; 42 (2): 318-25, 2007
- Levitt MA, Peña A. Ano imperforado, Tratamiento quirúrgico: Seguimiento: emedicina: Pediatría: Cirugía
- Levitt MA, Peña A. Resultados de la corrección de malformaciones anorrectales Curr Opin Pediatr: 17 (3): 394-401, 2005
- Misra D, Mushtaq I, Drake DP, Kiely EM, Spitz L. Las anomalías urológicas asociadas en el ano bajo imperforado son capaces de causar una morbilidad significativa: una experiencia de 15 años en Urología. Agosto de 1996; 48 (2): 281-3.
- Borzyskowskyi M, Mundy A. El manejo de la vejiga neuropática en la infancia Pediatr Nephrol 2: 56–66, 1988
- Geraniotis E, Koff SA, Enrile B es el uso profiláctico de la cateterización limpia intermitente en el tratamiento de lactantes y niños pequeños con mielomeningocele y disfunción de vejiga neurogénica. _J Urol _ 139 : 85–86, 1988
- Warne SA, Godley ML, Wilcox DT (2004) La reconstrucción quirúrgica de la malformación cloacal puede alterar la función de la vejiga: un estudio comparativo con anomalías anorrectales. J Urol 172: 2377-2381
- Boemers TM, Beek FJ, van Gool JD, et al (1996). Problemas urológicos en malformaciones anorrectales. Parte 1: Hallazgos urodinámicos y significación de anomalías sacras. J Pediatr Surg 31: 407–410
- Mosiello G, Capitanucci ML, Gatti C, et al (2003) Cómo investigar la disfunción neurovesical en niños con malformaciones anorrectales. J Urol 170: 1610-1613
- Warne SA, Wilcox DT, Ledermann SE, Ransley PG (2002) Resultado renal en pacientes con cloaca. J Urol167: 2548–2551
- Davies MC, Creighton SM, Wilcox DT. Resultados a largo plazo de las malformaciones anorrectales Pediatr Surg Int. 20: 567-572, 2004.
- Holt B, Pryor JP, Hendry WF. Infertilidad masculina después de la cirugía para el ano imperforado. J Pediat Surg; 30: 1677-1679, 1995.
- Levitt MA, Bischoff A, Breech L, Pena A. Fístula rectovestibular: rara vez reconoce anomalías ginecológicas asociadas. J Pediat Surg; 44: 1261-1267, 2009
- Iwai N Resultados de la corrección quirúrgica de la malformación anorrectal: 10-30 años de seguimiento. Ann Surg; 207: 219-222, 1998
- Davies MC, Liao LM, Wilcox DT, Woodhouse CRJ Creighton SM, BJU Int. 2009 3 de noviembre.









