Micción Disfuncional y Otros Desórdenes de Incontinencia Urinaria Diurna
Mike O'Brien
Departamento de Urología, Royal Children's Hospital, Melbourne, Australia
Traducido y editado desde el original al español | Enlace a la versión en inglés
Dr Juan Pablo Corbettaa, Prof Dr J. Garrahanb
aHospital de Pediatria
bBuenos Aires Argentina
Introducción
Muchos están familiarizados con la declaración a menudo citada de Thomas Watson, presidente de IBM, quien en 1943 declaró que "creo que hay un mercado mundial para tal vez cinco computadoras". Menos conocida, pero igualmente inexacta, es la declaración de Bloomfield en 1956 sobre "debido al número relativamente pequeño de niños afectados, no es rentable hacer un estudio más detallado acerca de la enuresis diurna".
Los desórdenes de incontinencia urinaria diurnos son en gran parte el resultado de cómo se "construye" un niño: desde anomalías anatómicas, neurológicas o cómo usan lo que tienen. Este es el último grupo de trastornos miccionales en los que se centrará este capítulo.
Tabla 1. Desórdenes del tracto urinario inferior
| Almacenamiento | Eliminación | |
|---|---|---|
| Vejiga hiperactiva y urgencia de orinar | Micción disfuncional | |
| Incontinencia urinaria de esfuerzo | Vejiga hipoactiva o neurogénica | |
| Incontinencia de la risa | Obstrucción | |
| Alta frecuencia urinaria diurna | Reflujo vaginal | |
De acuerdo con la Sociedad Internacional de Continencia Infantil, la micción disfuncional es un subtipo específico de anormalidad miccional diurna [^1]. Es el resultado de la contracción regular e inapropiada del esfínter uretral durante la micción. Como tal, no es estrictamente un desorden miccional diurno, aunque puede estar asociado con la incontinencia urinaria. Las condiciones del tracto urinario inferior definidas por la ICCS (siglas del término en inglés "International Children's Continence Society") se pueden dividir en anormalidades de cualquiera de las dos funciones principales de la vejiga, el almacenamiento o la eliminación (Véase Tabla 1). No obstante, existe una superposición considerable entre estas condiciones y la agrupación de los pacientes en una categoría, es aún más compleja que con la enuresis. Los pacientes pueden tener síntomas de más de un subtipo (por ejemplo, vejiga hiperactiva y micción disfuncional) o pueden evolucionar de una categoría a otra. En otras palabras, pueden mostrar síntomas de más de un subtipo de forma sincrónica (por ejemplo, vejiga hiperactiva y micción disfuncional) o progresar metacrónicamente, desde un subtipo a otro (por ejemplo, vejiga hiperactiva a posposición de la micción y a vejiga hipoactiva).
Hasta la publicación en 1998 y la posterior revisión en 2006 de la terminología estandarizada para la disfunción del tracto urinario inferior, había suficiente variabilidad en la definición de incontinencia urinaria pediátrica, por lo que era difícil realizar una comparación y evaluación significativa. Varios autores colocaron diferentes niveles de énfasis en la gravedad, frecuencia o duración de los episodios de incontinencia. La diversidad cultural, la metodología de investigación científica y las tasas de respuesta a los cuestionarios por parte de la población, han creado mayor confusión en cuanto a las tasas de prevalencia. No obstante ello, lo que resulta evidente de estos estudios es 1) una variación geográfica (probablemente el resultado de un umbral más bajo a la hora de informar, junto con una mejor documentación); 2) una prevalencia ligeramente mayor entre las niñas, especialmente a medida que crecen; y 3) una reducción en la prevalencia al aumentar la edad (Véase Tabla 2).
Para comprender la fisiopatología de la disfunción miccional, primero es necesario comprender las complejidades subyacentes a la función del tracto urinario inferior.
Genética/Etiología
Tabla 2. Tasas de Prevalencia de Incontinencia Urinaria
| Autor | Año | Nación | Método de Selección | Tamaño de la muestra | Tasa de respuesto | Edad (años) | Prevalencia | Ref | |
|---|---|---|---|---|---|---|---|---|---|
| J. Blomfield y cols. | 1956 | Reino Unido | Todos los niños nacidos en Edimburgo en la primera semana de marzo de 1946 y seguidos por profesionales de la salud | 5386 | 92% | 6 | Total - 2.9%Varón - 1.8%Mujer - 4.1% | Lancet, June 2, 850-852 | |
| T. Thomas | 1980 | Reino Unido | Encuesta postal de todos los pacientes en las listas de prácticas familiares de 12 médicos clínicos en diferentes partes del país | ||||||
| Nota del traductor: Fui a la fuente y modifiqué el contenido porque no se entendía y de hecho estaba incorrecto. | 22430 | 89% | (5-85)5-14 | Varón - 17.8%, Mujer - 16.4% | BMJ, 281, 1243-1245 | | |||
| D. Bloom y cols. | 1993 | Estados Unidos | Un cuestionario oportunista de niños entrenados para ir al baño encontrados en la práctica clínica de rutina. Se excluyeron los pacientes sometidos a evaluación o tratamiento de condiciones genitourinarias. | 3000 | 40% | 1.5-27 | 4 años - 13%6 años - 10%8 años - 10%10 años - 1% | J Urol, 149, 1087-1090 | |
| L. Swithinbank y cols. | 1998 | Reino Unido | Todos los niños elegibles en las escuelas que rodean el hospital del distrito. Sin criterios de exclusión. El paciente completó el cuestionario. La misma cohorte fue reevaluada 4 años después. | 1987 | 60% | ||||
| 80% | 11-12 | ||||||||
| 15-16 | Varón - 7.2%, Mujer - 16.6% | ||||||||
| Varón - 0.98%, Mujer - 4.7% | BJU Int, 81, 90-93 | | |||||||
| P. Sureshkumar y cols. | 2000 | Australia | Todos los niños por comenzar las clases en 1998, de escuelas seleccionadas al azar en el área metropolitana de Sydney. Sin criterios de exclusión. Cuestionario disponible en 6 idiomas diferentes. | 2020 | 70% | 6 | 19.2% (como mínimo un episodio pasados los 6 meses)2% mojaron 2 ó más veces por semana | J Pediatrics, 137, 814-818 | |
| E. Bakker y cols. | 2002 | Bélgica | Todos los estudiantes en los últimos 2 años de escuela primaria de escuelas seleccionadas al azar. Sin criterios de exclusión. Todas las clases sociales representadas. | 5646 | 77% | 11.5+/- 0.5 | Total - 7.9%Sólo diurna - 4%Diurna y Nocturna - 3.5% | Sacnd J Urol Nephrol, 36, 354-362 | |
| U Soderstrom y cols. | 2004 | Suecia | Todos los estudiantes en primer y cuarto grado de la escuela primaria en la ciudad sueca de Eskilstuna. Sin criterios de exclusión. | 2222 | 67% | 7.4 10.4 | Varón - 6.8%, Mujer - 5.8%Varón - 4.1%, Mujer - 4.3% | Acta Pediatr, 93, 386-389 | |
| M. Kajiwara y cols. | 2004 | Japón | Todos los estudiantes que asisten a 11 escuelas seleccionadas al azar de 140 instituciones. Excluyeron a niños con antecedentes de enfermedad neurológica. | 6917 | 76.4% | 7-12 | Varón - 6.2%Mujer - 6.3% | J Urol, 171 403-407 | |
| T. Hansakunachai y cols. | 2005 | Tailandia | Todos los estudiantes de primero a sexto grado de 8 escuelas seleccionadas al azar de 50 áreas de autoridad educativa en Bangkok. Sin criterios de exclusión. | 4966 | 69.5% | 5-15 | 0.34% | J Dev Behav Pediatr, 26, 356-360 | |
| V. Loening-Baucke | 2007 | Estados Unidos | Estudio retrospectivo de casos a partir de historias clínicas de todos los niños entre 4-17 años vistos en la clínica pediátrica de atención primaria del hospital universitario. Pacientes excluidos si no se los analizó antes de los 6 meses de edad. | 482 | Not applicable | 4-17 | 5.1% | Arch Dis Child, 92, 486-489 | |
| P. Sureshkumar y cols. | 2009 | Australia | Selección aleatoria de niños, en los primeros 4 años de escuela, de escuelas en el área metropolitana de Sydney. 60 (72%) de las 83 escuelas abordadas aceptaron participar. Cuestionario administrado a los padres. Sin criterios de exclusión. | 8160 | 35% | 5-13 | Total - 16.9%Varón - 13.7%Mujer - 21.5% | J Urol, 181, 808-816 | |
| J.M. Chung | 2011 | Corea | Una selección aleatoria de 26 jardines de infantes y 27 escuelas primarias en Corea. Cuestionario administrado a los padres. Sin criterios de exclusión. | 19240 | 85.8% | 5-13 | Varón - 4.6%Mujer - 4.3% | Urology, 76, 215-219 | |
| L Swithinbank y cols. | 2010 | Reino Unido | Estudio poblacional continuo que analiza la salud y el desarrollo de los niños. Los padres completaron cuestionarios. Sin criterios de exclusión. | 13973 | 69%64%61%59%56% | 4.55.56.57.59.5 | 13.6%7.8%9.7%6.9%4.4% | Acta Pediatr, 99, 1031-1036 | |
Como se discutió en el capítulo sobre Enuresis Nocturna, se ha demostrado cierta predisposición genética a la enuresis. Por el contrario, la genética y la heredabilidad de la incontinencia urinaria diurna no se han estudiado exhaustivamente. Esto se explica en parte por la diversidad de causas y la naturaleza heterogénea de la población de pacientes. Sin embargo, sigue surgiendo evidencia que ilustra la etiología multifactorial de la disfunción miccional. El Estudio Longitudinal Avon de Padres e Hijos (ALSPAC, del inglés "Avon Longitudinal Study of Parents and Children"), fue establecido para entender cómo las características genéticas y ambientales influyen en la salud y el desarrollo en los padres e hijos. Se trata de un estudio prospectivo de una cohorte de casi 14,000 neonatos. En otro informe sobre 8,230 niños, la prevalencia de incontinencia urinaria diurna fue del 7,8%, de los cuales el 6,8% tuvo mojaduras infrecuentes (<2 episodios / semana) y el 1% presentó mojaduras 2 veces por semana con mayor frecuencia [^1]. La odds ratio de un niño con un historial materno de incontinencia urinaria diurna durante su niñez y enuresis infrecuente fue de 2.64, y de 5,47 si el padre había sufrido de incontinencia urinaria diurna durante la infancia. Los odds ratios fueron aún mayores en los niños con enuresis severa. En aquéllos con historial materno fue de 3,28, y en aquéllos con historial paterno fue de 10,1. La complicación adicional de los esfuerzos para identificar asociaciones genéticas es la naturaleza heterogénea de los diversos subtipos de incontinencia urinaria diurna, por ejemplo, disfunción miccional, síndrome de urgencia miccional, enuresis risoria, polaquiuria, etc. La disfunción miccional puede tener una predisposición congénita o hereditaria respaldada por el hallazgo de una mutación de pérdida de función en el gen de la heparanasa 2, en pacientes con síndrome urofacial (Ochoa) [^2]. Este último fue originalmente descripto por Elejalde en 1979, pero llamado después síndrome de Ochoa, por el Dr. Bernardo Ochoa quien contribuyó con 36 pacientes con vejiga no neurogénica neurogénica e 'inversión' de las características faciales o una mueca facial característica al sonreír (http://omim.org/entry/236730) . Los pacientes afectados a menudo se presentan prenatalmente o en la infancia temprana (antes de la edad de ir al baño) lo que sugiere una patogenia congénita en lugar de adquirida.
Fisiología
Las funciones normales de la vejiga, como almacenamiento y eliminación de orina sin fugas, son el resultado de interacciones complejas entre la vejiga, los sistemas somático, autonómico y nervioso central. La capacidad aparentemente simple y única de la vejiga para acomodar volúmenes crecientes de orina a bajas presiones es el resultado de interacciones bastante complejas entre las células del músculo liso y la matriz extracelular de la pared de la vejiga [^3]. La matriz extracelular en lugar de ser simplemente un andamio para las células de la pared de la vejiga se está remodelando continuamente en reacción al estrés y tensión que se le aplican en un proceso denominado "reciprocidad dinámica". Además de colágenos, elastinas, lamininas e integrinas, la matriz extracelular está inundada de sustancias bioactivas tales como metaloproteasas de matriz (enzimas que generan proteólisis -proteasas- en presencia de metales) y una serie de factores de crecimiento desde el factor de crecimiento endotelial vascular (VEGF, por "Vascular Endothelial Growth Factor") a factores de crecimiento epidérmico (EGF, por "Epidermal Growth Factor") y factores de crecimiento transformante (TGF, por " Transforming Growth Factor") [^4]. La cantidad de colágeno en la pared de la vejiga es considerable, con más de un tercio del peso de la vejiga seca, constituida por colágeno. Aunque parte del colágeno se puede encontrar con los haces musculares, la mayor parte del mismo en la pared de la vejiga se encuentra fuera de dichos haces musculares. La capacidad de la vejiga para mantener cantidades razonables de orina a baja presión es un reflejo de su elasticidad. La vejiga tiene componentes activos (musculares) y pasivos (colágeno, etc.). Se ha demostrado que su capa mucosa interna tiene la capacidad de expandirse con poca o ninguna resistencia debido, al menos en parte, a la presencia y composición del colágeno contenido en la misma. La capa exterior del detrusor sirve para limitar esta distensión de una manera activa [^5]. El resultado es una vejiga distensible que generalmente almacena la orina a una presión de menos de 10-15 cm de H2O hasta que la vejiga alcanza su capacidad máxima. Existe una correlación entre la elasticidad de la vejiga y las cantidades de colágeno tipo I y III. La obstrucción de la salida se asocia con una mayor deposición de colágeno tipo III que a su vez induce hipertrofia muscular que da como resultado un engrosamiento de la pared de la vejiga y una disminución de su elasticidad [^3].
Una discusión detallada de la neurofisiología de la vejiga va más allá del alcance de este capítulo. En su forma más simple, la vejiga tiene tres fuentes de entrada neurológica [^6].
- Nervios eferentes parasimpáticos, que promueven el vaciamiento de la vejiga al inducir la contracción del detrusor y la relajación de la salida o cuello de la vejiga, salen del canal espinal entre S2 y S4 y se incorporan a la vejiga en el nervio pélvico.
- Nervios eferentes simpáticos, que inhiben la contracción del detrusor y estimulan la contracción del músculo liso uretral para promover la continencia, salen de la médula espinal toracolumbar entre T10 y L2 y se incorporan a la vejiga en el nervio hipogástrico.
- Los nervios eferentes somáticos, cuyos cuerpos celulares se encuentran en el núcleo de Onuf a lo largo del borde lateral de la materia gris ventral de la médula espinal, salen de S2 a S4 e ingresan al esfínter uretral externo en el nervio pudendo.
Hay dos tipos principales de fibra aferente dentro de la vejiga y se encuentran fundamentalmente en un el plexo suburotelial.
- Fibras A-delta mielínicas que responden a la distensión de la vejiga.
- Fibras C no mielinizadas, en gran parte inactivas en vejigas normales, pero que se activan en condiciones patológicas como inflamación, etc.
El control neurológico supraespinal superior está mediado por el centro miccional pontino o Núcleo de Barrington que coordina la contracción del detrusor y la relajación del esfínter en respuesta a la entrada sensorial de la vejiga que asciende a través de la sustancia gris periacueductal, el tálamo y el hipotálamo. El control consciente de la micción se origina en la circunvolución cingulada anterior y también es coordinada via el centro miccional pontino.
Actuando a través de un reflejo espinal, el llenado de la vejiga es detectado por las fibras A-delta, iniciándose la activación simpática de los músculos del cuello de la vejiga y la uretra proximal a través de receptores a-adrenérgicos así como la relajación del detrusor a través de los receptores b-adrenérgicos. Además desencadena la activación somática del esfínter uretral externo. La micción comienza en la corteza cerebral y con la relajación del esfínter uretral externo junto con la inhibición de la actividad simpática y la contracción del detrusor inducida parasimpatéticamente.
El neurotransmisor primario involucrado en el control de la micción es la acetilcolina que actúa sobre dos receptores diferentes: nicotínico y muscarínico. Los receptores nicotínicos tienen poco o ningún papel en el control de la micción. Hay cinco subtipos de receptores muscarínicos, M1 a M5, de los cuales los subtipos M2 y M3 son los más prevalentes en la vejiga. Los receptores M2 (70%) son predominantes, pero los M3 son los principales responsables de la contracción del detrusor.
Todas estas estructuras están presentes al nacer, pero en común con la mayoría de las funciones neuromusculares volitivas en los recién nacidos humanos no se desarrollan funcionalmente al nacer. La tasa de adquisición del control de la orina ha sido determinada por varios estudios, pero el más reciente y relevante es aquel realizado por Sillen y cols. quienes en una serie de publicaciones han estudiado prospectivamente las tasas de continencia en niños desde el nacimiento de bebés prematuros hasta 6 años [^7],[^8],[^9]. Encontraron que en la cultura occidental donde el entrenamiento para usar el inodoro es impulsado por la conciencia sensorial del niño, y que el 31%, 79% y 100% de los niños de 2, 3 y 4 años respectivamente, presentan la sensación de plenitud de la vejiga. La edad promedio para alcanzar la sequedad diurna fue de 3,5 años y todos menos uno de los niños estaban secos por la noche dentro de los 10 meses de haber contenido la orina durante el día. Existe evidencia de que el inicio temprano del entrenamiento para ir al baño se asocia con una finalización más temprana, pero lleva más tiempo [^10].
La evidencia adicional de la relativa inmadurez del control de la micción en el nacimiento se refleja en el vaciamiento vesical incompleto / micción interrumpida debido a una supuesta descoordinación del detrusor-esfínter. Observaron micción interrumpida en fetos basados en ultrasonografía antenatal repetida, en el 58% de los neonatos prematuros, en el 33% de los recién nacidos a término, en el 25% de los niños de 1 año y en el 3% de los niños antes del entrenamiento para ir al baño. Esta descoordinación ha sido demostrada urodinámicamente por este grupo y otros [^11].
La edad para lograr la continencia es impulsada principalmente por normas socio-culturales, apoyadas por la edad creciente y por la edad significativamente más temprana en que se alcanza la continencia en diferentes culturas. Por ejemplo, los Digo en África Oriental, cuyos bebés son continentes durante el día y la noche a la edad de 5-6 meses [^12]. De manera similar, se ha demostrado una edad temprana en el entrenamiento para ir al baño en niños vietnamitas [^13]. Esta diferencia cultural no se debe a diferencias heredadas o genéticas en la maduración del sistema nervioso central, ya que la técnica se aplicó con éxito a un niño italiano [^14].
También aprovechamos esta capacidad para imponer el control cortical aprendido en la función del tracto urinario inferior en niños mayores cuando aplicamos entrenamientos con métodos de biorretroalimentación para tratar a niños con problemas de continencia.
Fisiopatología
Intentar y definir la fisiopatología o etiología de la micción disfuncional pediátrica u otros trastornos de la enuresis diurna es difícil dada la naturaleza variada de presentación y clasificación. De acuerdo con la ICCS la pérdida incontrolable de orina puede ser continua o intermitente [^1]. La incontinencia continua casi siempre se debe a una anomalía anatómica y no se analizará con más detalle en este capítulo. Estrictamente hablando, el término incontinencia intermitente, la pérdida diurna o nocturna de cantidades discretas de orina, no se aplica hasta después de los 5 años; sin embargo, si el niño ha estado seco previamente durante un período de 6 meses o más, la investigación y la intervención no necesitan retrasarse. La incontinencia nocturna intermitente se aborda en el capítulo sobre Enuresis Nocturna. Existe un gran solapamiento entre la presentación diurna de la incontinencia y la progresión ocasional de uno a otro. Para mayor claridad y para facilitar la comparación de artículos / series publicados, el ICCS recomienda firmemente un mayor énfasis en la descripción precisa de la sintomatología del paciente utilizando su terminología prescripta en lugar de intentar clasificar a los pacientes en subgrupos específicos. Dicho esto, hay algunos grupos específicos que se pueden definir razonablemente con precisión:
Polaquiuria o Frecuencia Urinaria Diurna Extraordinaria
Este término se refiere a los niños que presentan con frecuencia pequeños volúmenes miccionales durante el día. La definición de la ICCS exige que orinen al menos cada hora. No obstante, la mayoría de los casos orinan con una frecuencia mayor que ésta [^1],[^15]. Una característica patognomónica única es la ausencia de poliuria nocturna. La patogenia no se entiende. La ingesta dietética de irritantes de la vejiga, el estrés psicosocial o emocional e incluso los factores climáticos han sido implicados.
La ausencia de una clara precipitación de factores provocadores está indicada por la escasez de modalidades de tratamiento exitosas. La piedra angular del tratamiento es la seguridad de que la afección es autolimitada, dura de unos días a raramente unos pocos años, pero en promedio 6 meses y la recurrencia es rara. Para el 50% que tiene un consejero especializado en estrés psicosocial o emocional que identifica correctamente el evento estresante subyacente y la historia natural de la afección, es todo lo que se necesita. Claramente, el manejo debe incluir la exclusión de desencadenantes dietéticos conocidos, como refrescos con cafeína, jugos de frutas ácidas, bebidas con alto contenido de oxalato de calcio. No existe una terapia farmacológica ideal, pero el tratamiento con anticolinérgicos como la oxibutinina tiene algunos méritos empíricos para los casos refractarios o prolongados. Para algunos la biorretroalimentación del suelo pélvico ha tenido éxito, pero aún no se ha probado en un ensayo aleatorizado para distinguir el beneficio de la resolución espontánea.
Enuresis Risoria
Es una condición muy específica en la que el paciente, generalmente una mujer, que no presenta ningún síntoma del tracto urinario inferior, sufre un vaciado completo de la vejiga durante o inmediatamente después de la risa. La ICCS considera importante distinguir la incontinencia de la risa aislada genuina de la risa provocada por la hiperactividad del detrusor (este último grupo de pacientes tiene una estrecha investigación sobre otras disfunciones del tracto urinario inferior) [^1]. El volumen frecuentemente grande del episodio de incontinencia provocado por la risa es la característica definitoria para la cual aún no se ha identificado ninguna causa.
Se han hecho analogías y comparación con la cataplexia. La cataplexia es un componente crucial de la narcolepsia, un trastorno caracterizado por somnolencia diurna excesiva, sueño REM anormal, alucinaciones hipnagógicas, cataplexia y parálisis del sueño [^16]. La cataplexia se asocia con una pérdida repentina del tono muscular estriado que puede limitarse a los músculos faciales o de las extremidades, pero puede ser más extenso. Por lo general, se desencadena por las emociones positivas, como la risa. Hay una fuerte historia familiar en pacientes con narcolepsia con predisposición hereditaria. El 85-95% de los pacientes portan el alelo HLA DQB1 * 0602. Se ha demostrado que la narcolepsia está asociada con la pérdida de hipocretina (un neurotransmisor asociado a la vigilia presente en el líquido cefalorraquídeo) del hipotálamo. Cómo se relaciona esto con la cataplexia o con la enuresis risoria aún no se ha dilucidado.
Dadas las similitudes con la cataplejía, Sher y Reinberg formularon la hipótesis de una patogenia similar y aplicaron metilfenidato (Ritalin, previamente utilizado para la narcolepsia / cataplejía) a niños refractarios con enuresis risoria con un éxito variable en todos [^17]. Este éxito se ha repetido posteriormente con una serie más grande de pacientes. Para los pacientes en quienes el Ritalin falló o no fue tolerado, el tratamiento se enfocó en modificaciones de conducta tales como el vaciado frecuente de la vejiga, evitar situaciones que se sabe provocan risa y la esperanza de que crecieran fuera de esta patogenia, lo cual no parecía muy probable. Se ha demostrado que la terapia de biorretroalimentación del suelo pélvico resulta beneficiosa.
Micción Vaginal
Esto realmente es una forma de psuedo incontinencia en lugar de incontinencia verdadera ya que la orina que gotea inmediatamente después de la micción, al reanudar una postura erguida es la orina que durante la micción ha ingresado a la vagina. Se puede asociar con adherencias labiales en el niño más pequeño, posiblemente por causar vulvovaginitis recurrente que contribuye a las adherencias persistentes y vaciamiento vaginal en curso. Se presenta más típicamente en niñas mayores que tienden a tener sobrepeso y se atribuye a una mala postura miccional con rotación interna de las caderas y cierre del área perineal. Sentarse hacia atrás en el inodoro (frente a la cisterna) es a la vez diagnóstico y terapéutico. En la experiencia del autor, el cumplimiento de esta estrategia de tratamiento es efímero ya que generalmente requiere la eliminación completa de la ropa interior de una pierna. Sin embargo, confirma el diagnóstico y enfatiza al paciente la naturaleza curativa de la postura correcta.
Incontinencia por Estrés / Incontinencia de Esfuerzo
La incontinencia de esfuerzo genuina (del tipo que se observa en mujeres posparto) es excepcionalmente rara en niños neurológicamente y anatómicamente normales. Los episodios de incontinencia urinaria pueden verse precipitados por el ejercicio en atletas adolescentes. Se ha informado que la incontinencia urinaria, asociada con la tos en el 19-49% de las niñas aumenta al 30-69% de las mujeres adultas con fibrosis quística [^18].
Vejiga Hiperactiva, Síndrome de Urgencia, Síndrome de Urgencia-Frecuencia
De acuerdo con la Sociedad Internacional de Continencia Infantil, "el sello subjetivo de la vejiga hiperactiva es la urgencia (la experiencia repentina e inesperada de una necesidad inmediata de orinar)" asociada con la incontinencia urinaria y el aumento de la frecuencia miccional [^1]. Es probablemente la causa más común de incontinencia urinaria en niños y se la conoce por varios sinónimos que incluyen vejiga hiperactiva, hiperactividad del detrusor o vejiga irritable. Se ha estimado que entre 5 y 7 millones de niños estadounidenses de 6 años en adelante se ven afectados por la incontinencia urinaria, con una incidencia máxima entre las edades de 5 y 7 años [^19]. Durante demasiado tiempo, la vejiga hiperactiva se consideró como el resultado de un retraso en la maduración del control de la micción o una regresión a un patrón infantil, de ahí el sinónimo de vejiga infantil persistente. A pesar de afectar a más de 34 millones de personas en los EE. UU. y un costo anual estimado de U$S 12.6 billones, la patogénesis de la vejiga hiperactiva aún no se comprende completamente [^20]. En pacientes adultos, la vejiga hiperactiva se ha asociado con varias etiologías diferentes: 1) neurogénica (por ejemplo, espina bífida, lesión de la médula espinal); 2) miogénica (por ejemplo, obstrucción, hiperplasia prostática benigna), 3) inflamatoria (por ejemplo, cistitis intersticial, infección); 4) idiopática [^21]. Aunque los niños también pueden estar sujetos a estos mismos factores predisponentes, la mayoría (y el enfoque de este capítulo) presentan hiperactividad del detrusor idiopática.
La urgencia se ha descrito como el síntoma fundamental de la vejiga hiperactiva [^22] y, de hecho, es el único síntoma que el paciente debe tener para diagnosticar vejiga hiperactiva. Dado el papel fundamental de la urgencia en el diagnóstico de la misma, es imperativo poder apreciar, evaluar y cuantificar objetivamente su presencia y gravedad de la patología. Implícito en la definición de urgencia está la comprensión de que se puede distinguir de la sensación normal de la vejiga de la necesidad de orinar a medida que la vejiga alcanza su capacidad. Para algunos pacientes, sin embargo, la urgencia es una sensación continua o crónica de la necesidad de orinar para evitar la incontinencia urinaria en lugar de una sensación de inicio repentino. No todos los episodios de urgencia producen incontinencia o micción; en aproximadamente el 50% de los casos el paciente no puede suprimir la urgencia. Distinguir la urgencia significativa de lo "normal" se complica aún más por el descubrimiento en una investigación de la necesidad urgente de orinar (<15 minutos) en el 10% de las mujeres [^22].
Cómo se evalúa la urgencia miccional también es objeto de mucha investigación y debate. La herramienta más simple es preguntar. Sin embargo, al preguntar estamos expuestos a una serie de sesgos de confusión que incluyen, pero no se limitan, al sesgo de recuerdo, sesgo de opinión anterior y mi propio sesgo favorito, el de obsequiosidad (donde las respuestas son alteradas por los encuestados en la dirección que perciben deseada por el investigador) [^23]. Brubaker, para demostrar la complejidad de evaluar la urgencia miccional como síntoma, realizó una excelente analogía entre ésta y el hambre. La percepción sensorial del hambre se intensifica al preguntar al respecto o en un entorno donde el sujeto está expuesto a la visión, los sonidos y los olores de los alimentos. Mecanismos neurofisiológicos similares podrían estar en juego en la urgencia miccional asociados con el agua corriente, el lavado de manos o colocar la llave en la puerta de entrada. Para poner a prueba la hipótesis de este investigador, otros investigadores han desarrollado dispositivos activados por los pacientes para registrar y calificar la gravedad de la urgencia miccional y correlacionar estos resultados con los de los estudios urodinámicos (24,25). Otros han desarrollado y validado una "escala de urgencia miccional" para medir dicha urgencia [^26]. Todavía existen otros sistemas de puntuación subjetivos ("Escala de Gravedad de la Urgencia Miccional" de Indevus, "Puntuación de Percepción de Urgencia" (UPS, del inglés "Urgency Perception Score") y otros más objetivos como los diarios (Tiempo de Advertencia - el intervalo entre la primera sensación de urgencia miccional y la micción; diarios registrando esto último), con las medidas objetivas para una mayor confiabilidad, repetibilidad y menor susceptibilidad a la confusión entre las sensaciones de urgencia miccional y de llenado vesical normal [^27].
La urgencia puede estar mediada central o periféricamente. La urgencia mediada centralmente puede apoyarse en la urgencia provocada por la 'llave en la cerradura", en inglés "latch-key" descripta anteriormente. Además, la urgencia miccional en pacientes sin aumento demostrable de la presión del detrusor y la reducción de la urgencia al inicio de la micción, cuando la presión del detrusor aún está aumentando, respaldan una fuente supra-vesical. No se sabe si la urgencia de 'latch-key' es el resultado de una liberación mediada centralmente de la supresión cortical de un reflejo miccional espinal o representa alguna forma de condicionamiento Pavloviano desconocido [^28]. Casi todos (75-100%) los pacientes con lesiones supra-pontinas y el 25% de aquellos con enfermedad de Parkinson tienen sobreactividad del detrusor [^29]. La resonancia magnética funcional (fMRI) ha mejorado enormemente nuestra comprensión de la actividad cortical durante la fase de almacenamiento de la función vesical. En sujetos sanos normales, las señales aferentes de la vejiga y la uretra se reciben en la sustancia gris periacueductal (PAG) y se transmiten a través del tálamo a la ínsula para registrar la sensación de llenado de la vejiga. Esta actividad es monitoreada por la circunvolución cingulada anterior que coordina eficazmente la respuesta a estas señales además de la entrada motora y emocional, incluida la entrada de la corteza prefrontal donde la decisión de orinar o no surge finalmente, resultando en una decisión de relajar o mantener la inhibición del reflejo miccional [^30]. Las personas con urgencia miccional e incontinencia de urgencia demuestran respuestas cerebrales alteradas al llenado de la vejiga tanto a volúmenes bajos como altos de la vejiga y en respuesta a la hiperactividad del detrusor. Tienden a mostrar respuestas débiles con bajos niveles de llenado de la vejiga, respuestas exageradas (quizás aprendidas) en grandes volúmenes de vejiga y una actividad cortical prefrontal débil o desactivada durante la hiperactividad del detrusor que quizás explica la naturaleza involuntaria de la incontinencia de urgencia y la aparente falta de conciencia aparente observada.
La urgencia puede estar mediada central o periféricamente. La urgencia mediada centralmente puede apoyarse en la urgencia provocada por la 'llave en la cerradura", en inglés "latch-key" descripta anteriormente. Además, la urgencia miccional en pacientes sin aumento demostrable de la presión del detrusor y la reducción de la urgencia al inicio de la micción, cuando la presión del detrusor aún está aumentando, respaldan una fuente supra-vesical. No se sabe si la urgencia de 'latch-key' es el resultado de una liberación mediada centralmente de la supresión cortical de un reflejo miccional espinal o representa alguna forma de condicionamiento Pavloviano desconocido [^28]. Casi todos (75-100%) los pacientes con lesiones supra-pontinas y el 25% de aquellos con enfermedad de Parkinson tienen sobreactividad del detrusor [^29]. La resonancia magnética funcional (fMRI) ha mejorado enormemente nuestra comprensión de la actividad cortical durante la fase de almacenamiento de la función vesical. En sujetos sanos normales, las señales aferentes de la vejiga y la uretra se reciben en la sustancia gris periacueductal y se transmiten a través del tálamo a la ínsula para registrar la sensación de llenado de la vejiga. Esta actividad es monitoreada por la circunvolución cingulada anterior que coordina eficazmente la respuesta a estas señales además de la entrada motora y emocional, incluida la entrada de la corteza prefrontal donde la decisión de orinar o no surge finalmente, resultando en una decisión de relajar o mantener la inhibición del reflejo miccional [^30]. Las personas con urgencia miccional e incontinencia de urgencia demuestran respuestas cerebrales alteradas al llenado de la vejiga tanto a volúmenes bajos como altos y en respuesta a la hiperactividad del detrusor. Tienden a mostrar respuestas débiles con bajos niveles de llenado de la vejiga, respuestas exageradas (quizás aprendidas) dado grandes volúmenes de vejiga y una actividad cortical prefrontal débil o desactivada durante la hiperactividad del detrusor que quizás explica la naturaleza involuntaria de la incontinencia de urgencia y la aparente falta de conciencia observada.
Los trastornos neurológicos periféricos también se asocian con hiperactividad del detrusor como se observa en pacientes con esclerosis múltiple, que generalmente se relacionan con afectación de la médula espinal y también se observan en pacientes con lesión de la médula espinal [^29]. La compleja interacción entre los nervios periféricos y la micción se evidencia en la supresión exitosa de la hiperactividad del detrusor por la estimulación de la raíz del nervio sacro, la estimulación de la raíz del nervio dorsal del pene y la estimulación del nervio tibial posterior con estimulación eléctrica transcutánea [^31]. Independientemente de si la pérdida de la inhibición neurológica es el resultado de un trastorno neurológico central o periférico, ambos probablemente resulten en una actividad aferente aumentada a partir de la sensibilización de las fibras C normalmente silenciosas. Esto a veces se conoce como la hipótesis neurogénica sobre el origen de los síntomas del tracto urinario inferior [^32]. Las hipótesis alternativas, pero no necesariamente excluyentes, son las hipótesis miogénica y urotelial.
La hipótesis miogénica propone que una desregulación de la excitabilidad y comunicación del músculo liso del detrusor normal da como resultado contracciones de la vejiga desinhibidas. Contrario a la creencia popular, sabemos que la vejiga normal no es un contenedor elástico inerte que simplemente acomoda el aumento de los volúmenes de orina durante la fase de almacenamiento del ciclo de micción. Hemos sabido por más de 120 años que la vejiga durante el llenado demuestra contracciones autónomas o no rítmicas que no dan lugar a la micción [^33]. La teoría detrás de estos "micro-movimientos" o micro-contracciones fue que ambas facilitaban el estiramiento local o el microestiramiento de la pared de la vejiga y activaban señales "sensoriales" aferentes hacia las regiones corticales superiores [^34]. Estas contracciones localizadas se han demostrado en modelos animales e in vitro con tejido detrusor humano y se ha demostrado que son una característica de la célula muscular lisa (relacionada con la afluencia de Ca ++) en lugar de ser desencadenadas por la entrada neurológica, es decir, todavía ocurren en presencia de neurotoxinas [^35]. Todavía se está estableciendo cómo estas microcontracciones naturales y aparentemente esenciales se relacionan con contracciones de los detrusores más grandes y generalizadas, o extendidas, observadas en la hiperactividad del detrusor, especialmente cuando la capacidad de un impulso eléctrico para propagarse desde un miocito a otro disminuye en comparación con otros músculos lisos. Hay menos uniones de hendidura entre las células del músculo liso del detrusor adyacente que las observadas en el músculo liso cardíaco. No obstante, esta mayor resistencia o conductividad reducida observada en el detrusor se asocia con una excitabilidad local mejorada que puede ser relevante para esa fisiopatología de la hiperactividad del detrusor [^35].
La hipótesis urotelial destaca que el urotelio es mucho más que una barrera a prueba de agua, de hecho es posiblemente la estructura más compleja en la vejiga. El epitelio en sí tiene una serie de propiedades únicas que le permiten cumplir su función. La forma esférica de la vejiga proporciona el mínimo de la relación de superficie - volumen de orina durante la fase de almacenamiento. La capa más interna de células, adyacente al lumen, las denominadas células en paraguas o facetarias tienen la capacidad de modificar su superficie epitelial para proporcionar un mecanismo de estiramiento con volúmenes crecientes de vejiga [^36]. Es relativamente impermeable al transporte pasivo de moléculas, pero no se ha determinado aún si esto se debe a las uniones estrechas entre las células en paraguas o a la capa de glucosaminoglicanos de las uroplaquinas sobre la porción superior del epitelio. Debido a que el urotelio no es absolutamente impermeable, también tiene algunos mecanismos de transporte activo para garantizar la homeostasis celular urotelial [^37]. El urotelio tiene una inercia inherente que sirve para proteger y preservar su impermeabilidad.
Además de su función de barrera, el urotelio expresa una serie de receptores sensoriales que se encuentran más típicamente en los nervios periféricos. Estos incluyen el receptor de potencial transitorio V1 (TRPV1, del inglés "(transient receptor potential cation channel subfamily vanilloid member 1"). Se ha demostrado que la expresión de TRPV1 aumenta en la hiperactividad del detrusor idiopática y en la hiperactividad del detrusor neurogénico. También se ha documentado una mayor expresión de subtipos de receptores purinérgicos (P2X y P2Y) en detrusor hiperactivo idiopático y neurogénico y se cree que responden de forma autócrina o parácrina al ATP liberado del urotelio. Los receptores cannabinoides (CB1) también se han encontrado en el urotelio, al igual que los adrenoreceptores alfa y beta que, cuando se estimulan, liberan ATP y óxido nítrico. Los cinco subtipos de receptores muscarínicos se han identificado en el urotelio estando el M3 ampliamente distribuido, el M1 localizado en la capa de células basales y el M2 en las células en paraguas [^32]. El urotelio secreta una gama igualmente amplia de sustancias bioactivas como ATP, óxido nítrico, acetilcolina, el péptido relacionado con el gen de la calcitonina (CGRP, del inglés calcitonin gene related peptide). El ATP se libera en respuesta a la estimulación del factor estresante, muscarínico y adrenérgico, y a la estimulación del TRPV1. Al actuar sobre los nervios y las células intersticiales en el área suburotelial, se piensa que el ATP es indicativo de la plenitud de la vejiga, posiblemente activando la micción. El óxido nìtrico gatillado por los mismos estímulos parece tener una acción inhibitoria en la vejiga. Esto es sugerido por la inhibición de la hiperactividad del detrusor en animales tratados con donantes de óxido nítrico y a la inducción de hiperactividad cuando se someten a eliminadores de óxido nítrico. También se ha demostrado que las células uroteliales liberan acetilcolina en respuesta a la estimulación mecánica o química. Aún no se ha encontrado un rol específico para el CGRP en la vejiga.
Debajo del urotelio se encuentra la capa suburotelial funcionalmente igual de importante que contiene tejido conectivo, nervios y vasos sanguíneos. Mientras que las terminaciones nerviosas más sensibles en la vejiga se ubican en el músculo detrusor y se transmiten a través de las neuronas delta A mielinizadas. Las terminaciones nerviosas de las fibras C amielínicas por otro lado terminan en el urotelio y la lámina propia. En circunstancias normales, se cree que las fibras C sólo se activan por distensión de la vejiga mayor que la que activa las fibras A delta. Se cree que la activación de la fibra C se vuelve relevante en condiciones patológicas y, por lo tanto, puede ser más relevante para la sensación de urgencia [^38]. Muchos de los nervios de la lámina propia expresan receptores para la sustancia P y el CGRP, así como los receptores TRPV1 y P2X. Que las fibras C puedan ser estimuladas por neurotransmisores derivados del urotelio implica al urotelio directamente en la generación de urgencia. Además, la lámina propia contiene células intersticiales que forman un sincitio funcional que puede ayudar a propagar una onda de despolarización o una contracción localizada del detrusor en respuesta a los neurotransmisores derivados del urotelio. La hiperactividad del detrusor se ha relacionado con un aumento de la expresión de la unión comunicante en las células intersticiales de la lámina propia que posiblemente desempeñan un papel en la génesis del detrusor hiperactivo a través de una conductividad mejorada. Algunas de estas células intersticiales han demostrado recientemente tener propiedades similares a las células intersticiales derivadas del intestino de Cajal y, por lo tanto, son capaces de activación espontánea. Esto ha llevado a nuevas comparaciones con el sistema neuro-entérico gastrointestinal que sugiere que los nervios y las células intersticiales del urotelio pueden organizarse en plexos "miovesicales" funcionales en lugar de anatómicos, análogos al plexo mioentérico del tracto gastrointestinal [^39]. Claramente, el urotelio es un participante activo en lugar de un espectador inocente [^40].
Como hemos visto aquí y en el capítulo sobre enuresis, nuestra comprensión de la complejidad de las contribuciones neurológicas y vesicales a la función de la vejiga ha crecido exponencialmente en las últimas décadas. Ya no podemos ver la vejiga como una bolsa muscular sobre la que ejercemos el control volitivo. Más bien, la vejiga es un órgano sensorial complejo capaz de responder a una variedad de estímulos diferentes. Mientras que antes se pensaba que la sensación consciente de la vejiga surgía de manera consistente y predecible, comenzando con "primera sensación de llenado de la vejiga", "primer deseo de orinar" y "fuerte deseo de orinar" [^41], ahora sabemos que el sistema nervioso central, está constantemente inundado con información sensorial, que podría describirse como "ruido aferente" [^42]. La información sensorial aferente de la vejiga está llegando continuamente al sistema nervioso central y qué impulsos alcanzan la conciencia y desencadenan la micción quedan por dilucidar. La constante "transmisión" de las sensaciones de la vejiga, aunque no es consciente, pueden accederse a voluntad para proporcionar una instantánea del estado actual del llenado de la vejiga. Esta necesidad de "ignorar" alguna salida aferente de la vejiga, con el fin de concentrarse en otras actividades diurnas, puede explicar algunas de las características asociadas con la disfunción miccional, como la alteración de la sensación de la necesidad de orinar o a menudo del acto de micción.
Micción disfuncional, Síndrome de Eliminación Disfuncional, Vejiga Neurogénica No Neurogénica
La micción disfuncional, tal como se define en el ICCS [^1], es un término que solo se puede aplicar con evidencia de contracción esfinteriana inapropiada durante la micción cuando se realiza un estudio de uroflujometría o urodinamia que da como resultado una corriente urinaria entrecortada. Es el equivalente a la disinergia detrusor-esfínter observada en pacientes con neuropatía manifiesta y es el resultado de una pérdida de la coordinación normal entre el detrusor y el esfínter externo. Como es un síntoma de la fase miccional, puede coexistir con síntomas de la fase de almacenamiento, como la vejiga hiperactiva. De hecho, la micción disfuncional a menudo se considera que ha surgido como respuesta a la incontinencia de urgencia, en la que se desarrolla un tono elevado del suelo pélvico para evitar la incontinencia y, en última instancia, la pérdida de relajación adecuada durante la micción. Esto a menudo conduce a un vaciamiento vesical incompleto, altos residuos post-vaciado e infecciones recurrentes del tracto urinario que luego causan inflamación y urgencia urinaria creando así un círculo vicioso. Una hipótesis alternativa es que la micción disfuncional se debe a factores psicosociales (como se observa en niñas con antecedentes de abuso sexual) o fenómenos mediados centralmente (como se observa en niños con síndrome de Ochoa o TDAH) [^43]. Surge además mayor confusión de la actividad alfa-adrenérgica de los agentes de acción central utilizados para tratar el TDAH que, por lo tanto, puede precipitar o agravar la micción disfuncional.
El punto más extremo del espectro disfuncional es el síndrome de Hinman-Allen o la vejiga neurógenica no neurogénica [^44]. Originalmente descrito por Beer en 1915 como retención urinaria crónica en niños, tipo 2C o debido a la espasticidad del esfínter sin signos neurológicos, pero se presume debido a la enfermedad de la médula sacra [^45]. El síndrome de Hinman-Allen representa la etapa final de una disfunción miccional adquirida que ha sido cuestionado por publicaciones que han identificado pacientes tan pequeños como 5 meses, mucho antes de la edad de ir al baño o la adquisición del control volitivo de la vejiga [^46]. Jayanthi y otros han reportado casos diagnosticados postnatalmente pero con características prenatales de hidronefrosis severa que sugieren una etiología congénita o prenatal [^47]. Sin embargo, no hay ningún estudio de videourodinamia llevado a cabo en niños control asintomáticos que descoordinen y cuya micción de alta presión es un fenómeno normal. Al igual que con la hiperactividad del detrusor, nuestra comprensión emergente de la variada patogénesis de la micción disfuncional sugeriría que existen diferentes subtipos que pueden responder mejor a las diferentes estrategias de tratamiento, ya sea la hipnoterapia para pacientes de inicio tardío, o con abuso sexual y trastornos psicógenos, vesicostomía temprana para casos prenatales sospechosos pero no confirmados, o biorretroalimentación y/o alfabloqueantes para aquellos casos que se presentan en la infancia. Una de las características definitorias del síndrome de Hinman-Allen es la insuficiencia renal asociada, cuyo origen es probablemente multifactorial y está relacionado con presiones intravesicales altas, disminución de la distensibilidad de la vejiga, infecciones recurrentes del tracto urinario y reflujo vesicoureteral.
La asociación entre el vaciamiento disfuncional y el reflujo vesico-ureteral está bien documentada por Lapides en 1970. De los niños inscritos en el Estudio Internacional de Reflujo, el 18% tuvo micción disfuncional con una menor prevalencia entre aquellos con resolución espontánea de su reflujo [^43]. ) La relación entre el reflujo vesico-ureteral y la micción disfuncional es compleja, de causa y efecto. El reflujo vesico-ureteral puede surgir como resultado de la disfunción de la vejiga debido al reflujo que se observa en pacientes con obstrucción de la salida anatómica, como las válvulas uretrales posterior y en la hiperactividad del detrusor neurogénico o disinergia del esfínter del detrusor observada en pacientes con espina bífida. Existen numerosos estudios que documentan tasas de prevalencia del 38-75% de micción disfuncional en niños con reflujo vesico-ureteral [^48]. El tratamiento exitoso de la micción fallida con biorretroalimentación o la medicación anticolinérgica se ha asociado con la resolución del reflujo vesico-ureteral en 37-63% de los pacientes con un mejoramiento del grado de reflujo vesico-ureteral del 16-29%. En una revisión reciente de la literatura, Sillen no pudo mostrar convincentemente evidencia de un efecto positivo significativo en la resolución del reflujo vesico-ureteral luego del tratamiento de la micción disfuncional.
La relación entre la disfunción del intestino y la vejiga se ha discutido en otra parte. Dicha asociación está tan bien documentada que Koff acuñó el término Síndrome de Eliminación Disfuncional. De hecho, Koff descubrió que la disfunción intestinal (estreñimiento) tenía un impacto igual o más significativo en la resolución espontánea del reflujo vesico-ureteral [^49]. El síndrome de eliminación disfuncional es más común en niñas [^50] con un pico de incidencia entre 5 y 12 años de edad 51). Aunque existe una asociación, no se ha demostrado una relación causal clara.
Diagnóstico
Los pacientes generalmente se derivan a un urólogo pediátrico ya sea por infecciones recurrentes del tracto urinario o por incontinencia urinaria intratable > 99% [^52]. Por lo general, han estado recibiendo tratamiento de su médico de cabecera y / o pediatra (que puede o no tener interés en la incontinencia) durante algunos años antes de una posible derivación. El médico de referencia generalmente solicita una investigación urodinámica para confirmar o excluir una vejiga neurogénica oculta. El paciente / padres, por otro lado, generalmente esperan una cura "milagrosa" ya sea quirúrgica o no. Esta dependencia cada vez mayor de las pruebas e investigaciones de diagnóstico desmiente la importancia de una historia detallada y un examen físico. En mi experiencia, la consulta clínica inicial a menudo está llena de angustia parental y del paciente debido a la necesidad de comenzar de nuevo con una historia exhaustiva, etc. El cuestionario inicial debe centrarse en definir la naturaleza del problema para identificar las causas anatómicas de la incontinencia y la neuropatía oculta. Habiendo excluido estas causas estructurales del cuestionamiento de la incontinencia, deberían tratar de identificar el subtipo de disfunción miccional.
Cuando se toma un historial, es importante tener una buena comprensión de los hábitos miccionales del paciente. ¿Con qué frecuencia él/ella orina? Tres veces al día o menos es, por definición, una disminución de la frecuencia diurna, mientras que 8 veces o más representa un aumento de la frecuencia [^1]. ¿Con qué urgencia necesitan orinar una vez que sienten la necesidad? En otras palabras, ¿pueden esperar si tienen que hacerlo, por ejemplo, cuando están en el auto, en el cine, durante la clase, etc.? Cuando orinan, ¿lo hacen con un flujo continuo con facilidad o la corriente es intermitente o está asociada al esfuerzo? ¿Hay alguna dificultad para iniciar la micción o hay una sensación de vaciado incompleto? ¿Son incontinentes con la orina? Si es así en qué medida, por ejemplo ¿Tienen la ropa interior húmeda al final del día o necesitan un cambio frecuente de ropa durante el día? ¿Son continuamente incontinentes (sugestivos de una anormalidad anatómica como un uréter ectópico o epispadias) o es episódico y, de ser así, cuándo ocurre y qué pasa si algo lo provoca? ¿Sólo ocurre inmediatamente después de la micción en una adolescente con sobrepeso, lo que sugiere una micción vaginal o reflujo que luego se filtra cuando reanuda una postura erecta? ¿Sólo ocurre al final del día en una niña que evita orinar en la escuela? ¿Lo provocan risas que sugieren incontinencia? ¿Están al tanto de estos episodios antes de que ocurran, tal como ocurren o sólo después? ¿También son incontinentes u orinan durante la noche? ¿Cuánto tiempo ha estado pasando? ¿Alguna vez han estado secos por un período de 6 meses o más, esto distingue la incontinencia primaria de la secundaria? ¿Tienen algún dolor asociado con la micción? ¿Practican alguna maniobra de posposición de la micción (generalmente los padres son testigos más confiables de esto), por ejemplo la "danza del pis", los niños agarrados al pene, las niñas que muestran la reverencia de Vincent (se sientan en cuclillas para evitar la incontinencia urinaria, a menudo comparable con poner el corcho en una botella, pero es más probable que el mecanismo funcione mediante un reflejo espinal que suprime la contracción del detrusor) [^53] Para las niñas más pequeñas, es importante establecer si pueden sentarse en el inodoro con los pies apoyados, usar un escalón o un soporte que les de equilibrio. ¿Hasta dónde se quitan la ropa interior: las rodillas o los tobillos? Para las niñas mayores cuando orinan fuera del hogar, ¿se sientan o tratan de flotar sobre el inodoro "sucio"? ¿Usan los baños de la escuela?
¿Con qué frecuencia defecan? ¿Cuál es la naturaleza de su materia fecal? La escala Bristol Stool Form Scale es una ayuda visual muy útil, aunque la mayoría de las chicas niegan mirar su propia materia fecal ¿Pasan las heces fácilmente o con incomodidad y esfuerzo? ¿Hay alguna suciedad fecal en su ropa interior y, de ser así, en qué medida, una pequeña marca de 'paloma' o suficiente para requerir su remoción antes del lavado? ¿Cuál es la naturaleza de la ingesta de líquidos, el volumen, la frecuencia y la naturaleza del líquido consumido? Ciertos fluidos, como refrescos, jarabes oscuros, tés, café, etc. son más propensos a provocar o agravar los síntomas de almacenamiento. Los niños que se mojan de manera consciente y subconsciente reducen su consumo de líquidos para minimizar la probabilidad. La naturaleza de la ingesta de fibra dietética en relación con su hábito intestinal es importante en los niños con estreñimiento.
Tabla 3. Puntos destacados en la historia del paciente
| Antecedentes | Variables | |
|---|---|---|
| Hábitos miccionales | Frecuencia miccional, urgencia, posposición, naturaleza del chorro urinario, postura miccional | |
| Hábitos de defecación | Frecuencia, consistencia, esfuerzo, derrame fecal | |
| Hábitos dietéticos | Ingesta de líquidos y fibra | |
| Historia médica pasada | Incorporación de eventos prenatales, perinatales y postnatales, incluidos los hitos del desarrollo, los logros académicos, las infecciones previas del tracto urinario, la edad al inicio y el logro del entrenamiento para ir al baño | |
| Historia familiar | Disfunción miccional, enuresis, reflujo vesico-ureteral | |
| Historia social | Acontecimientos importantes de la vida como la llegada de un nuevo hermano, la separación de los padres, el nuevo hogar, etc. | |
Al indagar sobre su historial médico pasado, es importante determinar cualquier historial de infección del tracto urinario y analizarlo detenidamente para comprender los síntomas subyacentes que provocaron la investigación y la naturaleza y el detalle preciso de la adquisición de la muestra, el análisis y la interpretación. Es importante distinguir entre una infección del tracto urinario demostrada por cultivo y balanitis en niños o vulvovaginitis en niñas. Cualquier comorbilidad, especialmente del tracto genitourinario o neurodesarrollo, puede ser relevante. Los niños con TDAH tienen tasas significativamente más altas de incontinencia y otros síntomas de disfunción urinaria e intestinal que la población normal [^54].
El examen físico generalmente no es útil pero esencial. Está dirigido a detectar o excluir anomalías anatómicas. El examen comienza con la parte inferior del abdomen buscando una vejiga palpable y / o expresable, heces palpables sugestivas de estreñimiento y palpación de la sínfisis del pubis. Luego se extiende hasta los genitales en busca de adherencias labiales, un clítoris bífido y un seno urogenital en niñas y estenosis meatal o fimosis patológica en niños. También se puede observar escoriación o decoloración de la piel por incontinencia urinaria y manchas fecales o urinarias en sus calzoncillos. El examen se extiende hacia la parte posterior de la espalda y la región sacra en busca de signos de agenesia sacra o estigmas de disrafia espinal oculta, como una malformación vascular, un parche cutáneo peludo, un seno sacro o pliegues asimétricos de las nalgas. Un breve examen neurológico es una parte esencial del examen físico y comienza cuando el paciente ingresa al consultorio evaluando su modo de andar. El examen neurológico básico consiste en sensación y tono grueso de las extremidades inferiores, desgaste asimétrico de la pantorrilla, pérdida unilateral de los arcos plantares normales, sensación perineal / perianal y reflejo ano-cutáneo.
Investigaciones
La investigación inicial debe ser el análisis de orina y el cultivo de orina para excluir una infección del tracto urinario. Otras investigaciones iniciales pueden incluir un film abdominal simple a menudo denominado como KUB. Probablemente se lo denomine mejor film de BUCKS: B = bladder (vejiga), U = ureter (uréter), C = colon (colon), K = kidney (riñón) y S = spine (columna vertebral), siendo un beneficio adicional la información sobre los intestinos y la columna para descartar una disrafia. Una ecografía del tracto renal con evaluación de los volúmenes vesicales antes y después de orinar proporcionará información sobre el tracto urinario superior, como la presencia de un riñón doble en una niña que puede estar asociado con un uréter ectópico. En el nivel de la vejiga, el engrosamiento de la pared de la vejiga o los grandes residuos posteriores a la micción son sugestivos de micción disfuncional. En una gran serie de más de 1000 pacientes no seleccionados con ecografía miccional disfuncional, fue normal en el 97% [^52]. El papel exacto de las imágenes en la investigación aún no se ha determinado y debe decidirse en base al paciente individualmente [^55]. El uso de rutina de otras imágenes radiológicas generalmente se reserva para pacientes que presentan antecedentes de infecciones febriles recurrentes del tracto urinario [^52].
Quizás la 'investigación' inicial más crucial es un diario detallado. Los diarios han demostrado ser los más rentables de todas las investigaciones iniciales [^56]. Encontraron que los diarios tienen una sensibilidad del 88% y una especificidad del 83% para la detección de la hiperactividad del detrusor. La recomendación del ICCS es que se use un "diario de eliminación" (o vaciado de vejiga) detallado para la investigación inicial y que se use un "gráfico de frecuencia y volumen" menos exhaustivo para el seguimiento. Preferimos el "diario de eliminación" ya que también incorpora un registro de la función intestinal. Se ha escrito mucho sobre los diarios de vejiga: más de 1463 estudios publicados hacen referencia o investigan el papel de los diarios urinarios, variando desde "Gráficos miccionales" que simplemente registran los tiempos de micción, hasta "Gráficos de frecuencia / volumen" que incluyen volúmenes de orina a "Diarios vesicales" que adicionalmente capturan información sobre episodios de incontinencia, urgencia y consumo de líquidos [^57]. A pesar de esta ráfaga de publicación, todavía no hay un formato de diario validado. La duración óptima de un diario de vejiga aún no se ha determinado (y probablemente nunca lo será). Las duraciones de los diarios por lo general van de 1 a 14 días. Los diarios que tienen una duración demasiado corta tienen un problema de confiabilidad, mientras que aquellos que son demasiado largos tienen un problema con el cumplimiento, ya sea al comienzo ("desesperación del diario") o casi al final ("fatiga diaria"). Se ha demostrado que las duraciones de 4 días son tan confiables como los diarios de 7 días y actualmente la mayoría de los autores recomiendan un mínimo de 3 días, idealmente 4, pero 5 si el número de episodios de incontinencia es importante [^58]. El cumplimiento de la entrada de datos y la finalización del diario se mejora significativamente si se utiliza un diario electrónico en lugar de uno en papel. En un estudio de adultos con dolor crónico requerido para hacer diarios idealmente dentro de los 30 minutos y en el peor de los casos dentro de los 90 minutos, el paciente informó un cumplimiento con las anotaciones en el diario de papel del 90-95% mientras que el cumplimiento real fue del 11-20%, el cual se compara desfavorablemente con el 95% de cumplimiento real dado un diario electrónico [^59]. Se encontró que el 40% de los pacientes que completaron un diario de papel tenían al menos 1 día de 'acumulación' (donde los datos fueron ingresados retrospectivamente, lo que los hace mucho más susceptibles al sesgo de recuerdo que los diarios electrónicos. Se necesitan diferentes parámetros para diferentes duraciones diarias a fin de lograr fiabilidad [^60]. También se debe tener en cuenta el efecto placebo asociado con la finalización de un diario de vejiga y el inevitable sesgo que introduciría si el diario fuera completado por un período prolongado.
Se han desarrollado una variedad de sistemas de puntuación de síntomas para ayudar tanto con la evaluación del paciente en el momento del diagnóstico inicial como también para monitorear el progreso tanto clínicamente como en el contexto de los ensayos con drogas (61-65).
Tabla 4. Puntaje de percepción de urgencia (Blaivas et al. J Urol 2007; 177: 199–202).
| Grado | Definición | |
|---|---|---|
| 0 | Conveniencia (no hay urgencia) | |
| 1 | Urgencia leve (puede contener por más de 1 hora) | |
| 2 | Urgencia moderada (puede contener por 10-60 mins) | |
| 3 | Urgencia severa (puede contener por menos de 10 mins) | |
| 4 | Urgencia desesperada (debe orinar inmediatamente) | |
Es importante que un diario de vejiga tenga alguna forma de evaluación de urgencia validada (como el Nivel de gravedad de urgencia o el Puntaje de percepción de urgencia) [^66]; consulte la Tabla 4. Al proporcionar a los pacientes un diario para completarlo, debe explicárseles todo detalladamente, para asegurar una finalización adecuada y para minimizar la deseabilidad social y los sesgos de obsequiosidad. El diario de la vejiga ha sido demostrado por Abrams y Klevmark que es capaz de sugerir un diagnóstico clínico (Véase Tabla 5).
Tabla 5. Clasificación de Klevmark Modificada (Scand J Urol Nephrol 1996; 179: 47–53).
| Tipo de Patrón Miccional | Descripción de la Aplicación Clínica | | |
|---|---|---|---|
| Tipo 1 | volúmenes normales, frecuencia normal | pacientes normales | |
| Tipo 2 | volúmenes normales, frecuencia aumentada | poliuria, sugerente de aumento de ingesta de fluido | |
| Tipo 3a | volúmenes reducidos fijos, día y noche | sugerente de patología intravesical Ej. cistitis intersticial | |
| Tipo 3b | volúmenes variables reducidos, día y noche | indicativo de hiperactividad del detrusor | |
| Tipo 4 | volumen normal temprano por la mañana, variable y reducido durante el día | posiblemente psicosomático; sugerente de frecuencia aumentada compensatoria para evitar la incontinencia | |
| Tipo 5 | poliuria nocturna | idiopática; enuresis; falla cardíaca | |
El siguiente nivel de investigación implica la evaluación objetiva del flujo de orina a través del uso de uroflujometría aislada o combinada con electromiografía del piso pélvico. La uroflujometría simple sola es útil como una herramienta de detección donde (cuando se combina con la evaluación ecográfica del residuo post-miccional) cuando se repite puede documentar un índice de flujo normal. La evaluación del residuo post-miccional debe hacerse tan pronto como sea posible después de la micción para reducir la posibilidad de pseudo-residuos y los residuos consistentemente mayores a 20 ml deben considerarse patológicos. Mientras que el equipo de uroflujometría proporciona un análisis detallado del flujo de orina, como Qmax - flujo máximo, Qave - flujo medio, Vt - tiempo de vaciado, tQmax - tiempo de flujo máximo - estos son simplemente descriptores numéricos matemáticos de la forma de la curva de flujo urinario y como tales están sujetos a error y mala interpretación. La mayoría de los médicos ponen mayor énfasis en la forma de la curva de flujo. Existe un marcado acuerdo inter e intraobservador sobre la forma de una curva normal, pero no tanto en las curvas anormales [^67], incluso cuando los observadores son urólogos pediátricos [^68]. Sin embargo, dado que el objetivo principal de la uroflujometría es distinguir aquellos pacientes que se beneficiarían de la evaluación urodinámica más invasiva de aquellos que se someterían a una investigación innecesaria, sigue siendo una herramienta de evaluación valiosa.
Es una herramienta que se ha mejorado mucho mediante la adición de electromiografía (EMG) del piso pélvico [^69]. La adición de EMG permite la evaluación simultánea de la actividad muscular del piso pélvico con la evaluación del flujo de orina. El EMG del piso pélvico se registra de forma más precisa mediante el uso de electrodos de aguja con púas específicamente diseñados; sin embargo, estos no son particularmente atractivos para pacientes adultos y menos para niños. Es mucho más común usar electrodos de superficie que, aunque menos enfocados, logran el mismo fin. Glassberg y cols han utilizado uroflujometría/EMG combinadas para estratificar a los niños con una variedad de síntomas del tracto urinario inferior en uno de los 4 grupos definidos urodinámicamente [^70].
- Micción disfuncional: EMG del suelo pélvico activo durante la micción, con o sin hiperactividad del detrusor.
- Trastorno de hiperactividad del detrusor idiopático: hiperactividad del detrusor en el estudio urodinámico, con EMG del suelo pélvico inactivo durante la micción
- Trastorno de subutilización del detrusor: micción intencional infrecuente pero por lo demás normal
- Disfunción primaria del cuello de la vejiga
El mismo grupo descubrió que se podía lograr una clasificación similar con el uso de uroflujometría/EMG. Introdujeron el concepto de tiempo de latencia de la EMG: el intervalo entre el inicio de la relajación del suelo pélvico y el inicio del flujo de orina, entre 2-6 segundos en niños normales.
- Micción disfuncional - EMG del suelo pélvico activo durante la micción con o sin flujo entrecortado
- Trastorno de hiperactividad a. Trastorno de hiperactividad del detrusor idiopática A: un suelo pélvico inactivo durante la micción y un tiempo de latencia acortado (<2 segundos) b. Trastorno de hiperactividad del detrusor idiopático B: un suelo pélvico inactivo con un tiempo de latencia normal
- Trastorno de subutilización del detrusor: micción voluntariamente diferida con capacidad de vejiga expandida, pero un suelo pélvico inactivo.
- Disfunción primaria del cuello de la vejiga: tiempo de latencia prolongado (> 6 segundos) y una curva de flujo desplazada hacia la derecha con un suelo pélvico inactivo durante la micción
Si bien la terminología que usan no está estrictamente de acuerdo con las recomendaciones de ICCS, demuestran la utilidad de la Uroflujometría/EMG combinadas para diagnosticar y dirigir el tratamiento de niños con síntomas del tracto urinario inferior.
El lugar de la video-urodinamia formal aún es tema de debate; algunos argumentan que tiene un rol y otros argumentan que es un gasto innecesario y extravagante. Glassberg se refiere al grupo posterior como impresionistas, ya que basan su diagnóstico clínico y plan de tratamiento en los aspectos clave de la historia que consideran relevantes. Esto a menudo incrementa con alguna investigación no invasiva. El otro extremo, al que se refieren como puristas, cree que todos los pacientes requieren un estudio de video-urodinamia formal para un diagnóstico preciso. Esta precisión tiene un costo mayor [^69]. La realidad es que la mayoría de los pacientes son manejados adecuadamente con un enfoque menos invasivo. En una gran serie de 3500 niños con disfunción vesical no neurogénica, se seleccionaron 1000 casos para realizar una video-urodinamia basados en una historia de infección del tracto urinario, una pequeña capacidad de la vejiga que no responde a la uroterapia, uroflujometría disfuncional repetida, anomalías ecográficas y resistencia al tratamiento [^71]. Encontraron estudios urodinámicos normales en el 6%, síndrome de urgencia (58%), micción disfuncional (31%) y vejiga perezosa (4%). Lo que no mostraron en ese documento fue el impacto de la urodinamia en el manejo o el resultado del paciente. Otros también informaron un alto rendimiento diagnóstico de la urodinamia en niños con disfunción vesical no neurogénica que reporta anormalidades normales (37%), fase de almacenamiento, predominantemente hiperactividad del detrusor (42%) y anormalidades en la fase miccional en el 21% [^72]. Dicho esto, la gran mayoría de los informes no recomiendan la realización de estudios urodinámicos de rutina, sino que recomiendan que se utilicen para aquellos pacientes que no responden a la terapia (52,73,74).
Manejo No-Operatorio
Si bien el tratamiento de la disfunción miccional se debe adaptar y personalizar al subtipo particular de disfunción del tracto urinario inferior con el que el paciente está afectado, existen algunas intervenciones terapéuticas iniciales que son aplicables a todos. Estas medidas se han denominado colectivamente: uroterapia. Inicialmente se denominó "terapia compuesta" en Escandinavia en la década de los '80 e incluía terapias conductuales, cognitivas y físicas, incluida alguna de biorretroalimentación. Hoy en día, el término uroterapia abarca la educación del paciente y la familia, el manejo de fluidos, el manejo óptimo del intestino y posiblemente la reeducación / biorretroalimentación del músculo pélvico y la neuromodulación, esencialmente las medidas no quirúrgicas y no farmacológicas. Una vez que se ha realizado un diagnóstico clínico, el paso inicial y posiblemente el más importante es educar al paciente y a sus padres sobre la naturaleza de la afección, lo que esencialmente desmitifica su problema y elimina cualquier culpabilidad. La terapia comienza con modificaciones del comportamiento basadas en la historia, el examen clínico, el diario de eliminación y la uroflujometría con medición del residuo post-miccional. Para las niñas, el consejo inicial debe enfocarse en la postura de vaciado. Es importante asegurarse que las niñas puedan sentarse con los pies apoyados (en el piso o en un escalón). Todas las niñas deben sentarse con sus caderas en abducción abriendo el piso pélvico para optimizar el flujo de orina y evitar la micción vaginal. Para aquéllas con antecedentes de infección del tracto urinario, se debe enseñar la higiene perineal postmiccional adecuada. Para aquéllas con irritación perineal o vulvovaginitis, se recomienda la sustitución de ropa interior sintética (por ejemplo, poliéster) por tejidos más transpirables, como el algodón. Existe la sospecha de que algunos alimentos / bebidas pueden causar irritación perineal similar a los que están implicados en la cistitis intersticial. Estos incluyen jugos de cítricos, chocolate, refrescos carbonatados, comidas picantes, tomate y vinagre por nombrar algunos [^75].
Una recomendación frecuente es la exclusión de las bebidas con cafeína basadas en la evidencia in-vitro de estimulación directa del detrusor por la cafeína y la hiperactividad del detrusor urodinámicamente demostrada. Después de la ingestión inicial de cafeína en voluntarios sanos, hay una diuresis demostrable a la que los sujetos parecen volverse resistentes con la administración continua [^76]. No se ha investigado si los pacientes con disfunción de la vejiga desarrollan la misma tolerancia. Swithinbank y cols. no encontraron ningún beneficio de la exclusión dietética de las bebidas que contienen cafeína sobre las tasas de incontinencia en mujeres adultas con incontinencia por estrés o de urgencia [^77]. Una serie de estudios epidemiológicos que analizaron a más de 16000 pacientes adultos en total no encontraron ninguna correlación entre la ingesta de cafeína autoinformada y los síntomas de la incontinencia. En el estudio prospectivo más grande hasta el momento, al observar la relación entre la ingesta de cafeína y la incontinencia urinaria que involucró a más de 21000 pacientes, no se pudo detectar una correlación obvia entre el consumo de cafeína y la progresión de la incontinencia urinaria [^78]. El mismo grupo que informó sobre más de 65000 adultos encontró que el alto consumo de cafeína, pero no los niveles bajos, se asociaron con la incontinencia [^79]. A pesar de esto, hay estudios que informan una reducción en los episodios de incontinencia en adultos sintomáticos luego de una reducción en el consumo de cafeína [^80]. Por lo tanto, una restricción o eliminación de bebidas con cafeína sigue siendo una recomendación generalizada.
Existe evidencia en pacientes adultos con obesidad e incontinencia urinaria de una reducción en episodios de incontinencia equivalente a la observada con algunas terapias conductuales o farmacológicas. Las mujeres obesas, con un IMC de 25-45 Kg / m2, que perdieron entre 5-10% de peso corporal tuvieron al menos una reducción del 50% en la frecuencia de episodios de incontinencia [^81].
El diario de eliminación identificará a los niños que no orinan con frecuencia y se beneficiarán de un régimen de micción cronometrada para alentarlos a miccionar un mínimo de 5 veces por día e idealmente 7. Para los niños pequeños, un padre puede recordarles antes de ingresar a la escuela que pueden guiarse por el horario escolar para vaciar la vejiga durante el día en la institución. Desafortunadamente, muchos padres informan que estos recordatorios a menudo resultan en conflicto con el paciente que "no siente la necesidad de orinar" y lo hará una vez que termine la actividad en la que está involucrado en ese momento. Para estos, un sistema de recompensa 'Tabla de Estrellas' (similar a la utilizada cuando se entrena para ir al baño) puede ayudar a reducir este conflicto y comprometer al paciente. Para aquellos niños que están lo suficientemente motivados y desean hacerse cargo de su problema, un reloj vibratorio como el VibraLITE o el reloj Wobl se puede configurar para que vibre silenciosamente en el momento apropiado para que sus compañeros no se den cuenta. La micción regular programada también es una piedra angular en el manejo de niños con hiperactividad del detrusor, donde se puede usar para restablecer buenos patrones de micción al establecer una frecuencia mínima de micción, Ej. 7 veces al día, y además, alentarlos a orinar en cualquier otro momento cuando sientan la necesidad de hacerlo. Se ha demostrado que la adición de un reloj programable hace una contribución adicional significativa al manejo de niños con incontinencia de urgencia diurna. En comparación con un grupo de control que recibe uroterapia estándar, la adición de un reloj programable para recordar al paciente 7 veces al día produjo una reducción significativa de los días húmedos en el 60% de los casos, lo que se tradujo en un 60% de niños continentes en una mediana de 6 meses en comparación con el 30% de los que no estaban usando un reloj [^82]. La posposición de la micción debe evitarse en todo momento, ya que, en lugar de fomentar una mayor capacidad de la vejiga como se esperaba, refuerza la supresión subconsciente de la sensación de vejiga llena. Hubo un período de finales de los '70 y '80 cuando Frewen y otros propugnaban el "entrenamiento de la vejiga", en el que se animaba a los pacientes a posponer la micción para prolongar los intervalos entre micciones. Informó que el entrenamiento de la vejiga dio como resultado un 87% de mejora subjetiva y un 53% de mejora en los síntomas urinarios anormales. Lo más interesante fue que lo primero en mejorar fue la nicturia [^83]. Sin embargo, hubo una alta tasa de recaídas [^84]. Sus afirmaciones de que "los efectos nocivos sobre la función de vaciado de la vejiga urinaria frecuente y urgente" pueden convertirse en un "hábito adictivo" que luego se propagará a sus hijos a través de un proceso de mimetismo no tendría credibilidad alguna con nuestra creciente comprensión de la función de la vejiga [^85].
El intervalo inicial ideal entre micciones puede basarse en el diario de eliminación y aumentarse gradualmente, en incrementos de 15 minutos, a intervalos quincenales en respuesta a períodos secos exitosos. Para aquellos pacientes con micción disfuncional (pared vesical engrosada, altos residuos posmiccionales, infecciones urinarias recurrentes, uroflujometría anormal) puede ser necesario evacuar doble o triple (basado en la ecografía) para asegurar un vaciamiento vesical suficiente, minimizando así las infecciones urinarias recurrentes que, por supuesto, contribuyen a la hiperactividad del detrusor, la frecuencia, la urgencia y el vaciado incompleto perpetuando así el ciclo.
Las interacciones complejas entre la función intestinal y la vejiga sustentan la importancia de un manejo apropiado y adecuado del intestino como un paso inicial en el tratamiento de pacientes con síntomas del tracto urinario inferior. Aunque se ha identificado una asociación clínica entre la disfunción intestinal y la vejiga desde 1952, no fue sino hasta 1998 que su asociación se consolidó en el término "síndrome de eliminación disfuncional" [^49]. Loening-Baucke observó 234 pacientes consecutivos con estreñimiento funcional y encopresis y observó antecedentes de incontinencia urinaria diurna (29%), enuresis nocturna (34%) e infección del tracto urinario (11%). El alivio exitoso del estreñimiento en el 52% se asoció con la resolución de la incontinencia urinaria diurna en el 89%, la enuresis nocturna en el 63% y el cese completo de las infecciones del tracto urinario [^86]. Una piedra angular de la terapia inicial es enfocarse en lograr un hábito intestinal normal. Idealmente, un buen hábito intestinal se basa en la ingesta adecuada de fibra dietética y fluidos adecuados. La Academia Estadounidense de Pediatría ha recomendado que la ingesta diaria de fibra de los niños mayores de 2 años de edad [^87]. Dicho esto en un ensayo aleatorizado de suplementos de fibra dietética de España, los pacientes con estreñimiento crónico tenían una ingesta diaria de fibra superior a la edad + 5 g / día, lo que demuestra que hay más por hacer en el tratamiento del estreñimiento que simplemente aumentar la ingesta de fibra [^88]. Otra recomendación de rutina es aumentar la ingesta de líquidos (con la intención de mejorar la consistencia de las heces, uniéndose al aumento de fibra y mejorando la producción de orina. Sin embargo, no hay evidencia de un cambio en la consistencia de las heces en respuesta a una mayor ingesta de líquidos ya que el líquido sea hipo-, iso o hipertónico. Todo lo que parece afectar es la producción de orina, ya que la mayor parte del líquido se absorbe en el tracto gastrointestinal [^89]. Otras medidas no farmacológicas que se usan con frecuencia para tratar el estreñimiento incluyen ejercicio, prebióticos, probióticos, terapia conductual (asesoramiento, etc.), pero tampoco se ha demostrado en los ensayos clínicos que tengan ningún beneficio real sobre el placebo en adultos o niños (90,91). No obstante, la mayoría de los ensayos que se han llevado a cabo han sido débiles y se han centrado en un único aspecto de la terapia en lugar de una combinación. Intuitivamente, la fibra y los líquidos adicionales deberían tener un efecto complementario que, por sí solo, no produciría estreñimiento. Estas medidas deben ser seguidas con una administración agresiva de laxantes. Una vez que se ha identificado un régimen eficaz y no hay evidencia de la eficacia de un laxante particular sobre otro, el tratamiento con laxantes debe mantenerse durante meses y destetarse gradualmente. Hasta un 20% de los pacientes se "curarán" sólo con estos pasos
La respuesta a estas modificaciones conductuales y al diagnóstico clínico determinará la próxima intervención terapéutica que se ofrecerá. Mientras que las modificaciones conductuales anteriores se pueden incorporar fácilmente en la vida cotidiana de los pacientes, su éxito está determinado por la motivación del paciente y las tasas de abandono y recidiva. as tasas de éxito más altas provienen de aquellos programas que educan y capacitan a los pacientes y brindan apoyo intensivo y respaldo continuo [^92]. Weiner y cols informaron una mejoría de los síntomas en el 74% al año, manteniéndose en el 59% a los 5 años con uroterapia simple. De esos pacientes, el 77% recomendaría este tratamiento a otros [^93]. Todavía no se ha dilucidado si el mejor enfoque es introducir cada medida individualmente o utilizar un enfoque combinado desde el comienzo.
Terapia Muscular del Suelo Pélvico / Biorretroalimentación
Hace más de 60 años, se le atribuye a Kegel la introducción de la terapia muscular del suelo pélvico para tratar la incontinencia urinaria en mujeres adultas con incontinencia urinaria de esfuerzo en quienes informó el éxito en 64 pacientes con la ayuda de su "perineómetro" [^94]. Mientras que Kegel aplicó estos principios a las mujeres adultas con incontinencia posparto, fue Maizels quien primero aplicó el principio de biorretroalimentación a los niños [^95]. Se ha encontrado que dos tercios de los adultos que se han beneficiado del entrenamiento muscular del piso pélvico y han seguido practicando los ejercicios, han tenido una mejoría sostenida 10 años después [^96]. En la población pediátrica, la rehabilitación muscular del suelo pélvico se ha utilizado con éxito para aumentar la conciencia muscular en el suelo pélvico de niños con micción disfuncional, infecciones recurrentes del tracto urinario con vaciamiento vesical deficiente y reflujo vesico-ureteral. Lo que no está claro en la literatura es si la educación sola, los ejercicios de Kegel o la terapia de biorretroalimentación proporcionan el mejor resultado. La terapia de biorretroalimentación proporciona una monitorización en tiempo real de una función fisiológica particular de una manera audible o visual para permitir el control aprendido de esa función. La biorretroalimentación moderna para la disfunción del tracto urinario inferior generalmente se basa en uroflujometría o EMG del músculo del suelo pélvico. Hay una escasez de ensayos aleatorios publicados que evalúen la terapia muscular del suelo pélvico o la biorretroalimentación. Lo que se ha publicado prohíbe el metanálisis significativo ya que se han utilizado diferentes estrategias de tratamiento, a menudo definidas de forma incompleta, para un grupo heterogéneo de condiciones. Con una media de 2,8 sesiones de terapia conductual (rango 1-7) administradas por un psicólogo capacitado, informaron una mejoría en el control urinario diurno en 72.7% de los pacientes a los 12 meses que se mantuvo en 59.6% a los 5 años.
Wiener y cols. informaron resultados a corto y mediano plazo siguiendo lo que describen como terapia conductual simple para niños con incontinencia urinaria diurna [^93]. Los informes fueron realizados a partir de 48 participantes que respondieron, de una cohorte original de 74, con una mediana de seguimiento de 5 años. Este no fue ni un estudio aleatorizado ni un estudio ciego con algunos pacientes que recibieron asesoramiento, algunos anticolinérgicos y algunos ambos. Su conclusión de que una terapia de biorretroalimentación más intensiva / invasiva puede no ser necesaria en una gran proporción de pacientes presenta cierto mérito. En línea con este pensamiento, muchos centros han informado sobre su algoritmo de manejo de intervención creciente.
Para aquellos en quienes es necesaria una escalada a la biorretroalimentación, existe un número cada vez mayor de opciones de tratamiento. La biorretroalimentación basada en uroflujometría tiene como objetivo promover una curva de flujo de orina en forma de campana al proporcionar una visualización en pantalla en tiempo real durante la micción. Mientras que el tratamiento basado en uroflujometría ha demostrado obtener resultados similares a la terapia basada en EMG en menos sesiones, es una terapia muy laboriosa y la duración de la sesión debe prolongarse por la necesidad de volver a llenar la vejiga después de cada vaciado, con sesiones individuales tomando 6 horas en comparación con 45-90 minutos para el tratamiento basado en EMG [^97]. La biorretroalimentación basada en EMG que inicialmente usó rastros de computadora auditivos o lineales se ha convertido en juegos de computadora interactivos. Estos fueron presentados inicialmente por McKenna en 1999, quienes informaron tasas de éxito cercanas al 100% [^98]. Este alto nivel de éxito ha sido repetido por otros como Schulman, que informó una resolución del 80-100% de los días húmedos y una normalización del 67-94% de las curvas de uroflujometrìa [^97]. DePaepe y cols. informaron una resolución del 83% de las infecciones urinarias recurrentes secundarias a micción disfuncional con biorretroalimentación basada en EMG semanal; algunas requirieron hasta 24 sesiones [^99]. Porena y cols. informaron la resolución completa de la micción disfuncional en los 43 niños (ocurrieron más rápidamente en niñas) y el 87% de las infecciones urinarias recurrentes asociadas a los 2 años de seguimiento, que se redujeron al 80% a los 4 años [^100]. La aplicación de la biorretroalimentación basada en EMG se ha extendido a pacientes con hiperactividad del detrusor con informes sobre un 66% de éxito en pacientes con hiperactividad del detrusor refractaria [^101] que se cree que actúa al menos en parte mediante una mayor supresión de la contracción del detrusor, secundaria a la contracción del suelo pélvico [^102]. ) También se ha demostrado que tiene un impacto positivo en el reflujo vesico-ureteral que a menudo se asocia con la micción disfuncional con una resolución completa en el 63% de los casos y un grado de disminución en la gravedad en un 29% adicional [^103]. La terapia de biorretroalimentación sigue evolucionando con la experimentación continua de nuevas técnicas tales como la biorretroalimentación intravesical para aumentar la capacidad de la vejiga [^104].
Lo que queda por determinar son las preguntas sobre la selección ideal del paciente, la ubicación del tratamiento y la duración. De acuerdo con un enfoque cada vez más minimalista para la investigación y el manejo del paciente, algunas unidades brindan biorretroalimentación domiciliaria con un éxito razonable [^105]. Hubo una serie de estudios que intentaron cuantificar el beneficio adicional de la biorretroalimentación sobre la uroterapia estándar sin mucho éxito (97,106). Esto puede ser debido a la mala selección de los pacientes y la falta de heterogeneidad en la población de estudio. Lo que está claro es que la adición de animación por computadora acorta la duración del tratamiento necesario para lograr el mismo efecto (107,108). Todo el trabajo publicado en esta área apunta a dos áreas de importancia absoluta para un resultado exitoso: en primer lugar, un paciente motivado y obediente y, en segundo lugar, un especialista en uroterapia entusiasta, entrenado y dedicado (ya sea una enfermera, fisioterapeuta o médico).
Farmacoterapia
Al considerar la intervención farmacológica para pacientes con micción disfuncional y otros trastornos de la micción diurna, los agentes terapéuticos pueden dirigirse a la vejiga misma (músculo detrusor) o el cuello de la vejiga / uretra proximal. Para cualquiera de los objetivos uno puede elegir agentes destinados a estimular o suprimir.
Estimulantes o Agonistas
Estimulación directa de la vejiga, para pacientes con detrusor hipoactivo / vejiga perezosa, con agentes como Betanecol o Carbacol que actúan directamente sobre el receptor muscarínico, estimulándolo; o Distigmina, un inhibidor de la acetilcolinesterasa, que actúa evitando la descomposición de la acetilcolina en la unión neuromuscular y ha sido abandonado en gran medida debido a la falta de beneficio comprobado (109, 110). El betanecol, que se usó mucho para los trastornos de la motilidad gastrointestinal, está resurgiendo como procinético del detrusor para la prevención de la retención urinaria posterior a la histerectomía [^111].
La lista de neurotransmisores activos en el cuello de la vejiga y la uretra y por lo tanto objetivos potenciales para la farmacoterapia se expande constantemente, incluyendo a) alfa adrenérgico (- contracción) de los cuales hay 4 subtipos diferentes presentes y receptores beta adrenérgicos (- relajación) de los cuales hay 2 subtipos presentes; b) receptores colinérgicos muscarínicos (M2 y M3); c) vías no adrenérgicas no colinérgicas (NANC) que incluyen óxido nítrico, ATP, monóxido de carbono, VIP, neuropéptido Y, taquiquininas, prostanoides, endotelinas, 5-hidroxitriptamina, Rho-quinasa, por mencionar sólo algunos. Para una discusión más detallada sobre estas vías, se dirige al lector a los documentos de Canda y Schwinn (112,113). Muchas de estas vías / objetivos potenciales se han descrito recientemente y, como tales, los agentes terapéuticos aún no se han desarrollado.
Existe amplia evidencia de que la actividad alfa-adrenérgica contribuye significativamente al tono uretral. La efedrina y la fenilpropanolamina estimulan directamente los receptores alfa y beta y provocan la liberación local de noradrenalina y, por lo tanto, aumentan el tono uretral. Lamentablemente, no son específicos de la uretra y se asocian con presión arterial alta, palpitaciones, dolores de cabeza y temblores, lo que limita su uso clínico. Ha habido cierto éxito con su uso en mujeres posmenopáusicas adultas con incontinencia de esfuerzo cuando se usan en combinación con terapia de estrógenos [^114]. La imipramina es un antidepresivo tricíclico que inhibe la recaptación de noradrenalina, aumenta el tono uretral y aumenta la presión de cierre uretral. También tiene algunas propiedades anti-colinérgicas (discutidas en el capítulo sobre enuresis nocturna) y posiblemente un efecto central relacionado con su inhibición de la recaptación de serotonina [^115]. La duloxetina también es una noradrenalina y el inhibidor de la recaptación de 5-HT también ha demostrado ser mejor que el placebo para las mujeres que padecen incontinencia urinaria de esfuerzo [^116].
El clenbutarol, un agonista de los receptores beta, ha demostrado ser beneficioso en mujeres adultas con incontinencia urinaria, a través de un mecanismo desconocido pero posiblemente al actuar directamente sobre el músculo estriado de la uretra. Un beta-agonista selectivo de la vejiga puede ayudar en el tratamiento de la hiperactividad del detrusor y evitar los efectos secundarios cardiovasculares (taquicardia, hipotensión) de los no selectivos. Mirabegron es simplemente un agonista selectivo de los receptores beta 3 adrenérgicos que ya ha sido aprobado y probado en Japón; es bien tolerado, eficaz y está asociado con efectos secundarios mínimos [^117].
Inhibidores o Antagonistas
Los inhibidores o antagonistas pueden usarse para tratar contracciones vesicales inapropiadas como en la hiperactividad del detrusor o para reducir aún más la resistencia de salida y mejorar la eficacia del vaciado de la vejiga como en la micción disfuncional.
Anti-muscarinicos
La clase más común de fármacos utilizados para tratar la hiperactividad del detrusor es la familia de fármacos antimuscarínicos, que se cree que actúan bloqueando los receptores muscarínicos en el músculo detrusor, evitando la estimulación con acetilcolina. Dado que trabajan principalmente para reducir los síntomas de urgencia y para aumentar la capacidad de la vejiga "funcional" allí el mecanismo de acción exacto es incierto. Hay 5 subtipos de receptores muscarínicos (M1 - M5). En el detrusor humano, los receptores M2 representan 2/3 y M3 el resto. M3 es responsable de la contracción del detrusor en la vejiga normal. Los receptores M2 en la vejiga parecen funcionar para oponerse a la relajación vesical inducida por el sistema simpático. Los receptores M4 son presinápticos y, sin embargo, inhiben la liberación de neurotransmisores, mientras que se cree que M1 facilita la liberación de acetilcolina. Los receptores muscarínicos también se encuentran en las células uroteliales. Los fármacos antimuscarínicos ejercen su efecto durante la fase de almacenamiento de la función de la vejiga, durante la cual no hay actividad parasimpática. Debe haber alguna otra fuente de acetilcolina, posiblemente el urotelio, que esté contribuyendo al tono del músculo detrusor [^118]. Esto explicaría en parte la asociación de hiperactividad del detrusor e infección del tracto urinario o inflamación de la vejiga.
El bromuro de propantelina es un compuesto de amonio cuaternario, antagonista del receptor muscarínico no selectivo. Tiene una baja (5-10%) biodisponibilidad y debe tomarse cuatro veces al día [^119]. En una serie de estudios comparativos tanto en adultos como en niños con hiperactividad del detrusor idiopática, se ha demostrado que no es mejor que la oxibutinina TDS o en algunos casos, el placebo
El cloruro de trospio es otro compuesto de amonio cuaternario con actividad bloqueante no selectiva antimuscarínica y posiblemente ganglionar. Se ha demostrado que tiene un efecto similar a la oxibutinina, con menos efectos secundarios, en pacientes con hiperactividad del detrusor neurogénica. Curiosamente, se ha encontrado que tiene un mejor cumplimiento a largo plazo que muchos de sus rivales, tal vez en relación con su administración dos veces al día y un mejor perfil de efectos secundarios [^120].
El bromuro de emepronio es un compuesto de amonio cuaternario antimuscarínico no selectivo similar, administrado 4 veces al día con algún beneficio comprobado en mujeres adultas, pero no hay estudios en niños. El bromuro de emepronio ha sido retirado debido a la ulceración esofágica, sin embargo, el carragenato de emepronio aún puede estar disponible.
La oxibutinina es una amina terciaria que tiene efectos antimuscarínicos, relajante muscular directo y anestésico local (sólo relevante si se administra intra-vesicalmente). Es un compuesto quiral con enantiómeros R y S. La mayor parte de su impacto en la hiperactividad del detrusor está relacionado con sus propiedades antimuscarínicas. Es el primer anticolinérgico aprobado para su uso en la hiperactividad del detrusor, que fue aprobado por la FDA de EE. UU. En 1975. In-vitro es 500 veces más potente como agente antimuscarínico que como un relajante muscular directo. Parece tener una mayor afinidad por los receptores M1 y M3, que tiene una afinidad 10 veces mayor por los receptores M3 que por M2 [^121]. La formulación de liberación inmediata tiene una biodisponibilidad de aproximadamente el 6%, pero con una variabilidad marcada, hasta 8 veces mayor, entre los sujetos [^122]. La oxibutinina es metabolizada en el hígado por la isoenzima 3A del citocromo P450 en un metabolito activo N-desetil-oxibutinina que da como resultado concentraciones más altas que el compuesto original y puede ser en gran parte responsable del efecto terapéutico. La N-desetil-oxibutinina también parece tener una mayor afinidad por la glándula parótida, lo que la implica en el principal efecto secundario de la sequedad bucal. Dichos estudios han fallado en mostrar una correlación entre el volumen de producción de saliva y la sensación de boca seca [^123]. El tamaño relativamente pequeño de la oxibutinina y su metabolito primario, junto con su solubilidad en grasa, significa que atraviesa fácilmente la barrera sangre / cerebro y contribuye a su perfil de efectos secundarios del SNC. Las concentraciones plasmáticas de oxibutinina tienen una vida media de 2 horas [^124], pero dado el efecto terapéutico de su administración de metabolitos primarios, generalmente se recomienda la administración de BD o TDS. La dosis inicial de oxibutinina es algo subjetiva dada la variabilidad en la población de pacientes. Para niños menores de 5 años una dosis de liberación inmediata puede ser de 0,2 mg / kg / dosis de TDS o bien 1mg / año de edad de BD hasta un máximo de 5 mg de BD. Para aquellos entre 5 y 10 años de edad, 5 mg de BD y para aquellos > 10 años de edad, 10 mg de BD de liberación inmediata o 10 mg de BD de liberación prolongada una vez al día. En general, comenzamos con una dosis más baja (para evitar los efectos secundarios) y el aumento de la dosis, después de un fracaso para lograr el efecto deseado, en un intervalo de 1-2 meses [^122].
La oxibutinina está disponible en una serie de formulaciones que incluyen liberación inmediata, liberación prolongada y transdérmica. La formulación de liberación inmediata sigue siendo el estándar de oro con el que se comparan los medicamentos y formulaciones más nuevos. Para mejorar el cumplimiento a través de una dosificación menos frecuente y reducir los efectos secundarios al limitar los niveles máximos, se desarrolló una formulación única y diaria de liberación prolongada o de liberación lenta [^125]. La formulación de liberación prolongada utiliza un sistema de liberación osmótica (OROS®). Este consiste en un núcleo de 2 capas que contiene el cloruro de oxibutinina y los agentes osmóticos internos. Una vez en el tracto gastrointestinal, la entrada de agua crea una suspensión de la oxibutinina que se expulsa lentamente a través de un pequeño orificio en la membrana de la cápsula mediante la expansión de los agentes osmóticos [^126]. Se libera en todo el tracto gastrointestinal, pero principalmente en el colon, lo que minimiza su metabolismo de primer paso y resulta en una mayor biodisponibilidad de oxibutinina así como niveles reducidos de N-desetil-oxibutinina. La oxibutinina transdérmica evolucionó nuevamente a partir del deseo de evitar o minimizar el metabolismo de primer paso y es posible debido a su lipofilia. El sistema consiste en una tira de poliéster que se retira para aplicarse a la piel. La tira consiste a su vez en una capa protectora externa y una capa adhesiva que contiene tanto la oxibutinina como la triacetina para mejorar la penetración de la piel. Se aplica dos veces a la semana, alcanza un estado estable en la segunda aplicación y da como resultado fluctuaciones mínimas en las concentraciones plasmáticas de oxibutinina durante el período de uso de 96 horas. La construcción del parche es capaz de administrar 1 mg / día / cm2; actualmente el parche existe en un solo tamaño que administra 3,9 mg / día. Sin embargo, se puede cortar habiendo la misma certeza de dosis.
Se ha demostrado que la oxibutinina de liberación inmediata reduce la frecuencia urinaria en aproximadamente un 50% y estimula la incontinencia de urgencia en un 70% en comparación con el placebo [^124]. La formulación de liberación prolongada tiene la misma eficacia que la de liberación inmediata, pero se tolera mejor con una reducción de hasta el 57% de los efectos secundarios [^127]. El ensayo OBJECT (vejiga hiperactiva: juicio de control y tratamiento efectivos; del inglés "overactive bladder: judging effective control and treatment") encontró que la oxibutinina de liberación prolongada es más efectiva que la tolterodina de liberación inmediata con efectos secundarios similares. El ensayo OPERA (vejiga hiperactiva: rendimiento de los agentes de liberación prolongada; del inglés "overactive bladder: performance of extended release agents") encontró reducciones similares en la incontinencia de urgencia tanto con la oxibutinina de liberación prolongada como con la tolterodina de acción prolongada [^128]. La oxibutinina tuvo un mayor impacto en la frecuencia de la micción, pero se asoció con una mayor incidencia de boca seca. La oxibutinina transdérmica se asocia con menos quejas de boca seca que las preparaciones de liberación prolongada.
La tolterodina es otra amina terciaria, antimuscarínica que, aunque no es selectiva para ningún receptor muscarínico específico, tiene una selectividad mejorada para la vejiga sobre las glándulas salivales. Tiene una afinidad similar por los receptores muscarínicos como la oxibutinina y también experimenta un importante metabolismo de primer paso en el hígado a un metabolito activo, el 5-hidroximetil tolterodina. 7% de los caucásicos no metabolizan la tolterodina. Tiene una biodisponibilidad bastante marcada que oscila entre 10-70% que se potencia al consumir alimentos. Como se discutió anteriormente, se presenta en formatos de liberación inmediata y liberación prolongada que contienen el agente activo en microesferas solubles [^129].
La eficacia de tolterodina se ha discutido anteriormente. A diferencia del ensayo OPERA, el ACET (ensayo de eficacia clínica anti-muscarínica; del inglés "anti-muscarinic clinical effectiveness trial") halló que la liberación prolongada de tolterodina 4 mg tenía una mejor eficacia y tolerabilidad que la oxibutinina de liberación prolongada [^130].
La fesoterodina es una amina terciaria inactiva que se metaboliza en 5-hidroximetil tolterodina, el mismo metabolito que tolterodina. Se ha demostrado que tiene mayor eficacia que la tolterodina, pero con mayores tasas de sequedad de boca e interrupción debido a los eventos adversos [^131].
La solifenacina es una amina terciaria con selectividad M3. Tiene un 90% de biodisponibilidad después de la administración oral. Se ha demostrado que es tan efectiva como la oxibutinina pero con menos efectos secundarios. También se encontró que tiene una eficacia mejorada en comparación con tolterodina [^132]. Se ha utilizado con éxito moderado en el tratamiento de la hiperactividad del detrusor resistente a la terapia en niños [^133]. De los 108 pacientes en el estudio, el 42% había tenido complicaciones relacionadas con la terapia anticolinérgica previa, y solo 9 (6,5%) experimentaron efectos secundarios con la solifenacina. De los pacientes elegibles para la evaluación, el 85% mejoraron con solifenacina, de los cuales el 54% tuvo una respuesta completa y el 46% una respuesta parcial.
La darifenacina es una amina terciaria de diseño y un antagonista selectivo de M3 [^121]. Se ha demostrado que es mejor que el placebo para los síntomas urinarios, pero que causa una boca seca significativa. Dicho esto, ha demostrado tolerabilidad a largo plazo en un estudio abierto de adultos con > 40% de pacientes que afirmaron una reducción en los episodios de incontinencia a los 2 años > 90% [^134]. Una de las principales ventajas de darifenacina y solifenacina es la administración una vez al día.
Se ha demostrado que la propiverina, que se usa principalmente en niños con enuresis nocturna, tiene propiedades antagonistas anti-colinérgicas y de canales de calcio [^119]. De nuevo, se ha demostrado que tiene una eficacia similar en comparación con la oxibutinina, pero con menos efectos secundarios, experimentada en un 20% y relacionada principalmente con sus propiedades anticolinérgicas. En teoría, los bloqueadores de los canales de calcio al evitar el flujo de calcio podrían inhibir la contracción del detrusor. Ninguno de los estudios que hasta ahora han analizado la Nifedepina o el Verapamil han demostrado ser efectivos.
El flavoxato es un fármaco con mecanismo de acción incierto, pero con propiedades antagónicas conocidas de los canales de calcio, que también inhibe la fosfodiesterasa. Tiene una eficacia similar cuando se compara con la oxibutinina, con menos efectos secundarios.
La capsaicina y la resiniferatoxina son de una familia de compuestos llamados vaniloides. La capsaicina es el ingrediente en los chiles que provoca la sensación de ardor mediante la activación selectiva de neuronas sensoriales. Actúa estimulando los canales de cationes potenciales de receptores transitorios de la subfamilia vaniloide (TRPV-1). Actúa inicialmente estimulando y luego bloqueando o desensibilizando los nervios sensoriales posiblemente mediante el agotamiento de las reservas de neuropéptidos, en particular de las fibras C amielínicas. La capsaicina ha sido usada eficazmente en pacientes con hiperactividad del detrusor neurogénica y se ha encontrado que dura de 2 a 7 meses después de una sola administración, en aquellos pacientes para quienes funcionó. El efecto secundario más importante es la molestia intensa de la vejiga que se administra mejor mediante la administración bajo anestesia general o la administración intravesical previa de lignocaína [^119]. La resiniferatoxina se deriva de Euphorbia, una planta parecida a un cactus, que actúa de manera similar en el TRPV-1 pero con una potencia de 1000 veces comparada a la capsaicina, pero con solo 100 veces más efecto inflamatorio.
Parece tener menos efecto excitatorio (antes de la desensibilización posterior) que la capsaicina y, por lo tanto, puede ser una mejor alternativa. Si bien la resiniferatoxina se ha utilizado para pacientes con hiperactividad del detrusor neurogénica, no ha habido informes de su uso en niños que este autor haya podido encontrar y sólo se ha publicado un informe sobre su uso en pacientes con hiperactividad del detrusor idiopática. En un estudio no aleatorizado de pacientes adultos con hiperactividad del detrusor idiopática que no respondieron a la medicación anticolinérgica, se trataron con una instilación intravesical ambulatoria de resiniferatoxina semanalmente, precedida por lidocaína intravesical, durante 4 semanas con una tasa de respuesta del 50% [^135].
Elección de Anti-colinérgico
Kessler, en un gran metaanálisis sobre terapia anticolinérgica que analizó 69 ensayos y > 26000 pacientes, encontró que, con la excepción de la oxibutinina de liberación inmediata, todos los demás anticolinérgicos tienen perfiles de efectos secundarios muy similares [^136]. El costo y la disponibilidad son consideraciones importantes al elegir un anticolinérgico con poca información publicada sobre cualquiera de ellos. Hashim y Abrams en 2004 encontraron un diferencial de costos, en el Reino Unido, entre la liberación inmediata de oxibutinina y la tolterodina (cualquiera de las formulaciones) de 6 veces [^137]. Aquí en Australia, la liberación prolongada de oxibutinina, Tolterodina, Fesoterodina y Trospio no están disponibles, lo que influye en la selección.
Toxina botulínica
La toxina botulínica es una de las neurotoxinas más potentes conocidas, producida por Clostridium Botulinum, que se presenta en 7 sero-tipos (A-G) de los cuales 2 (A y B) se han usado clínicamente [^138]. Se une a los nervios periféricos, impidiendo la liberación de acetilcolina, al escindir las proteínas SNARE (receptor de fijación soluble a factor sensible a N-etilmaleimida; del inglés "soluble N-ethylmaleimide sensitive factor attachment receptor") -BTX-A escinde proteína asociada al sinaptosoma (SNAP-25)-; BTX-B escinde la proteína de membrana asociada a vesículas (VAMP). Esto evita la migración de vesículas presinápticas y su acoplamiento con la membrana presináptica en las neuronas. Las neurotoxinas bacterianas causantes del botulismo y el tétanos interfieren en la función de estas SNARE. Es importante entender que diferentes preparaciones de BTX-A (onabotulinum toxinA - Botox y abobotulinum toxinA - Dysport) tienen potencias dramáticamente diferentes. De manera similar, existe BTX-B en diferentes preparaciones (Myobloc y Neurobloc).
La BTX-A se usó por primera vez en 1998 para tratar la hiperactividad del detrusor neurogénica y la incontinencia urinaria en adultos con lesión de la médula espinal [^139]. Diecisiete de 21 pacientea mejoraron 6 semanas después y esto se mantuvo entre las 16 a las 36 semanas. Una revisión sistemática de la literatura realizada por Karsenty y cols. identificó 18 artículos que investigan la seguridad y eficacia del Botox en adultos con hiperactividad del detrusor neurogénica, y la mayoría de los estudios informaron porcentajes de continencia del 40 al 80% después de la inyección [^140]. Su uso en pacientes con esta condición se ha asociado con una reducción drástica en la necesidad de aumento de la vejiga [^141]. El efecto ocurre entre 7-30 días y dura de 6-9 meses. Se ha demostrado que mejora la calidad de vida en pacientes con detrusor hiperactivo idiopático y neurogénico [^142].
Se ha informado que el Botox intravesical en niños con detrusor hiperactivo neurogénico logra continencia en 65-87% de los casos [^143]. La dosis óptima de la onabotulinum toxinA para tratar la hiperactividad del detrusor se ha reducido gradualmente de un máximo de 300 UI a 100 UI sin pérdida de eficacia [^144]. De hecho, la reducción de la dosis inyectada a 100 UI produce una reducción significativa de las complicaciones relacionadas con Botox, como infección del tracto urinario, retención urinaria aguda y necesidad de cateterismo intermitente. El uso intravesical de 100 unidades de Botox en niños con hiperactividad del detrusor no neurogénica, resistente a la terapia anticolinérgica arrojó una respuesta completa en el 60% de los casos, una respuesta parcial en un 20% de los casos y ninguna respuesta en el 20% después de 6 meses de tratamiento, a expensas de una retención urinaria temporal en el 5% e infección del tracto urinario en el 10% [^145].
El primer uso de la toxina botulínica en un niño fue realizado por Steinhardt en 1997, donde se utilizó para tratar la dilatación uretral dramática en una niña con micción disfuncional [^146]. Desde entonces ha habido una serie de informes sobre su uso en niños con micción disfuncional. Franco y cols. informaron de forma retrospectiva sobre 16 pacientes con micción disfuncional e incontinencia urinaria comprobadas mediante EMG que habían fallado en todas las terapias anteriores, incluida la biorretroalimentación y la terapia con alfa-bloqueantes [^147]. Reportaron un 75% de sequedad y un 20% mejoraron después de una sola inyección, con una reducción significativa en los residuos post-vacío, pero curiosamente no hubo cambios en la uroflujometría. Una mejora similar, sin afectar la uroflujometría, fue demostrada por Petronijevic y se observó que duraba 6 meses [^148].
Alfa-bloqueadores
La estimulación de la gran concentración de receptores alfa que se encuentran en la región del cuello de la vejiga y la uretra da como resultado una mayor resistencia al vaciado [^149]. Cain y cols. informaron sobre 55 niños consecutivos con incontinencia urinaria y vaciamiento vesical inadecuado tratados con doxazosina a una dosis de 0.5-2 mg / día [^150] además de otra terapia "estándar". Encontraron una reducción del 88% en el volumen de orina residual postmiccional, una mejoría en la incontinencia urinaria en el 83% y una reducción en la urgencia en el 70%.
Direcciones futuras para la farmacoterapia
Nuestra mayor comprensión de la neurofisiología de la contracción de la vejiga revela nuevos objetivos potencialmente novedosos para el tratamiento de la disfunción del tracto urinario inferior, incluidos connexin 43 y c-kit (implicados en el acoplamiento celular o la traducción de señales); antagonistas de los receptores cannabinoides y antagonistas de los receptores beta 3 de la fosfodiesterasa [^151].
Neuromodulación
Para la minoría de pacientes cuyos síntomas persisten a pesar de la uroterapia, la biorretroalimentación y la farmacoterapia, el próximo nivel de intervención es alguna forma de neuromodulación eléctrica. Es difícil encontrar una definición clara de neuromodulación, pero, en esencia, es una terapia que tiene como objetivo provocar una modulación terapéutica de la actividad neuronal a través de la estimulación de los sistemas nerviosos centrales periféricos o autónomos. Sus orígenes se remontan al primer siglo DC donde Scribonius Largus describió la aplicación de peces Torpedo vivos para tratar la gota. El uso de la electricidad como agente terapéutico disfrutó de un gran resurgimiento a fines del siglo XIX y principios del siglo XX, pero en realidad han sido las últimas 2 o 3 décadas, junto con nuestra mejor comprensión de la neurofisiología, que se ha logrado un progreso significativo en esta área. Las técnicas neuromoduladoras se han aplicado con éxito a pacientes con dolor neuropático, anorexia, epilepsia, depresión, trastorno obsesivo compulsivo y ahora también con disfunción de la vejiga. Se han utilizado varias técnicas para tratar la hiperactividad del detrusor, incluida la estimulación neural eléctrica transcutánea (TENS, del inglés "transcutaneous electrical neural stimulation"), la estimulación del nervio tibial posterior (PTNS, del inglés "posterior tibial nerve stimulation"), la estimulación de la raíz nerviosa sacra implantable (Interstim, del inglés "implantable sacral nerve root stimulation"). Se desconoce el mecanismo exacto de acción de la neuromodulación, pero se cree que actúa a través de la estimulación de aferentes y eferentes de la vejiga. La hiperactividad del detrusor puede tener, en parte, su origen en la aparición de nuevos arcos reflejos que involucran fibras C dentro de la pared de la vejiga. Se cree que al estimular directamente estos nervios, la neuromodulación sacra puede interferir con estas contracciones reflejas. Se piensa que la PTNS actúa de manera similar, pero a nivel de la médula sacra o supraespinal, también el nervio pudendo, el nervio dorsal del pene y la estimulación endoanal [^152].
El tratamiento con TENS en niños con hiperactividad del detrusor, que fracasó con la terapia anticolinérgica se ha asociado con una respuesta inicial en el 76% y una curación al año en el 56% [^153]. Se han informado tasas de respuesta del 13-73% en niños con incontinencia urinaria diurna (154-156). Hasta la cuarta parte de los pacientes no pudo demostrar ninguna respuesta a la terapia con TENS [^157]. Es de destacar que en un elegante estudio aleatorizado y ciego (no fácil de realizar) de Lordelo y cols., hasta un tercio de los pacientes del grupo de simulación informaron una mejora significativa en los síntomas de vejiga hiperactiva, aunque ninguno informó curación [^158]. Dado que la terapia con TENS se asocia con molestias en el nivel de la piel, el cumplimiento del paciente es una preocupación con tasas de abandono o no cumplimiento del 11-22%. Malm-Buatsi y cols. informaron un cumplimiento incompleto del régimen de tratamiento debido a incomodidad en el 11% y abandono total en el 5,5%. Hoebeke reportó 22% de falta de éxito debido a la falta de motivación y, por lo tanto, presunto incumplimiento. Una vez que se detuvo el tratamiento, se han notificado tasas de recaída del 10-25% (153,158). Los avances en tecnología y electrofisiología han llevado al desarrollo de una nueva generación de máquinas TENS que utilizan corrientes eléctricas interferentes para minimizar la incomodidad de la piel y mejorar el cumplimiento (159,160). La erapia TENS tiene la ventaja adicional de poder administrarse en casa.
La estimulación posterior del nervio tibial, por otro lado, no puede administrarse en el hogar ya que esta terapia más invasiva implica la inserción de un electrodo de aguja percutánea cerca del maléolo medial del tobillo. De los 75 niños inscritos en 3 ensayos diferentes de mejoría sintomática de PTNS fue del 78-84% (161-163). Hasta un tercio de los pacientes suspendieron la terapia, de los cuales el 10% lo hizo debido al temor a la aguja [^161].
Interstim es un sistema implantado quirúrgicamente diseñado para administrar neuromodulación sacra que fue aprobado por la FDA para el tratamiento de la incontinencia de urgencia en 1997 y para el tratamiento de la retención urinaria desde 1999. Si un electrodo de aguja temporal insertado por vía percutánea (en el foramen S3) conectado a un generador de impulsos externo ha demostrado tener éxito, el sistema se convierte en un generador de impulsos completamente implantado. Desde 1997, se han instalado más de 100.000 unidades en todo el mundo, principalmente en pacientes adultos. Se informó que Interstim tuvo una tasa de éxito inicial en el 84% de 19 pacientes, con resolución completa de la incontinencia urinaria en el 16% y una mejoría (definida como una reducción de más del 50% en los síntomas) en el 68% de los casos [^164]. Los que mejoraron pasaron de una media de 1,45 episodios de incontinencia por día a 0,64. Este grupo de investigadores continuó siguiendo parte de este grupo de pacientes y también añadieron nuevos pacientes. Con una mejor selección de pacientes (basada principalmente en la motivación del paciente) informaron una mejoría del 88% en la incontinencia urinaria (75% de resolución completa, 12.5% de resolución parcial [^165]. También informaron mejoría en otras áreas, como urgencia urinaria (69%) y estreñimiento (71%). Reconocen abiertamente la naturaleza no aleatorizada de este estudio de una técnica aplicada a una cohorte de pacientes muy heterogénea. Mientras que sólo 5 (25%) de los pacientes resultaron asintomáticos, 6 (30%) pudieron dejar de utilizar la farmacoterapia adyuvante y 4 (20%) requirieron cirugía por complicaciones del dispositivo, quedando demostrado que la terapia Interstim puede utilizarse en niños cuidadosamente seleccionados con incontinencia refractaria con modesta esperanza de éxito.
La estimulación magnética funcional (FMS) usa un dispositivo capaz de generar campos electromagnéticos pulsantes de baja frecuencia, Ej. Pulsegen o NeoControl. En el único ensayo publicado para comparar FMS con neuromodulación eléctrica (FES), Yamanishi y cols. informaron aumentos tanto en la capacidad cistométrica máxima como en el volumen de la vejiga ante el primer deseo de orinar [^166]. Encontraron un aumento significativamente mayor (114 + / - 124 mls) en el grupo FMS en comparación con el grupo FES (32 +/- 57 mls), aunque el volumen medio previo al tratamiento en el grupo FMS fue pequeño comparado con el del grupo FES. FMS abolió completamente la hiperactividad del detrusor en 3 de 15 pacientes, mientras que FES no logró esto en ningún paciente. En un seguimiento de FMS controlado con placebo, no hubo curación alguna pero sí una reducción del 56% en los síntomas de incontinencia urinaria en el grupo control en comparación con el 26% del grupo placebo [^167].
Manejo Operatorio
La intervención quirúrgica para la micción disfuncional generalmente se reserva para aquellos pacientes intratables que han fallado en todas las intervenciones terapéuticas antes mencionadas. Afortunadamente, este es un porcentaje cada vez menor de la población en general, pero representa los que son los más difíciles de tratar. Claramente habrá habido alguna intervención quirúrgica por parte del urólogo antes de este punto, por ejemplo, la cistoscopía puede haberse realizado por razones de diagnóstico, para insertar un catéter suprapúbico, para video-urodinámia o para inyección de Botox. Es posible que se haya abordado neuroquirúrgicamente al paciente para insertar el electrodo para la terapia Interstim. Más allá de esto, la naturaleza de la intervención quirúrgica se adaptará al subtipo particular de disfunción miccional.
Los pacientes con baja actividad del detrusor, intercurrencias urinarias recurrentes secundarias a micción disfuncional con grandes residuos posmiccionales y aquellos con vejiga neurogénica no neurogénica pueden requerir intervención quirúrgica para facilitar el vaciado de la vejiga. El cateterismo intermitente limpio fue descrito originalmente por Lapides en 1972 [^168]. Curiosamente, describió el cateterismo limpio para ayudar a prevenir la infección recurrente del tracto urinario en pacientes con vejiga neuropática, pero no con el fin de reducir los residuos post-vaciado en sí mismos, que a su juicio eran de "dudosa importancia en la génesis de la infección urinaria". Por el contrario, creía que la presión intravesical aumentada comprometía el flujo sanguíneo intramural y, por lo tanto, alteraba las defensas inmunes del huésped. La ventaja del enfoque "limpio" es la preparación más simple; una revisión de Cochrane reciente no pudo encontrar evidencia de diferencia alguna en la frecuencia de infecciones del trato urinario cuando se comparó la cateterización "estéril" con la "limpia". En uno de los informes más extensos sobre el uso de cateterismo intermitente limpio en niños neurológicamente normales con disfunción miccional, Pohl y cols. publicaron 70% de tolerabilidad o cumplimiento en niños con uretra sensible [^169]. Con una edad promedio de 4.5 (1.5-9) años, 15 de estos niños aprendieron sobre la cateterismo intermitente limpio en 2 días, 4 se negaron a aprender después de la visita inicial y los 4 restantes tardaron 2 semanas en aprender (de los cuales 3 se detuvieron poco después).
Para el 30% de los niños en los que se ha identificado la necesidad de mejorar el vaciamiento de la vejiga pero que no pueden / no quieren realizar el cateterismo intermitente limpio por la uretra, es posible que sea necesario encontrar una ruta alternativa. Originalmente descrito por Mitrofanoff en 1980 para facilitar el vaciamiento de la vejiga en pacientes que se sometieron simultáneamente al cierre del cuello de la vejiga (16/23) o posteriormente se les cerró el cuello de la vejiga (otros 5 pacientes) en pacientes con vejiga neuropática [^170]. Con 20 años de seguimiento informaron 47% de complicaciones estomales del tipo estenosis o filtración y complicaciones intestinales (vólvulo o adherencias) en 5 (22%) pacientes. Esta técnica se aplicó a niños con uretra sensible (171-173). La técnica real de la formación de Mitrofanoff se discute en otra parte.
Para los pacientes con sobreactividad del detrusor una vez que se hayan agotado todas las terapias no operatorias, la intervención quirúrgica tiene como objetivo aumentar la capacidad funcional de la vejiga y reducir la presión máxima del detrusor que actualmente implica algún tipo de aumento de la vejiga en forma de cistoplastia de aumento o auto-aumento. El auto-aumento, originalmente descrito en 1989 por Cartwright y Snow, no es un procedimiento que produce un aumento tan grande en la capacidad de la vejiga como la ileo-cistoplastia y no perdura por largo tiempo [^174]. Se han abandonado otras técnicas, como la inyección trans-trigonal de fenol y la transección del detrusor, debido a la falta de eficacia y / o longevidad consistentes. La discusión detallada de las técnicas operatorias se trata en otra parte de este libro. La cistoplastia de aumento utiliza sigmoide o íleon, con preferencia por este último ya que resulta en un mejor cumplimiento y produce menos mucosidad. Debe recordarse que después del aumento una alta proporción de pacientes (33-50%) puede requerir cateterización intermitente. La cistoplastia de aumento sigue siendo una intervención de última elección [^175]. Se ha informado en adultos con vejiga neurogénica no neurogénica que producen una tasa de continencia del 93%. Además, se ha demostrado, después de 3 años, ser tan rentable como la neuromodulación sacra mediante la inyección de Botox. Se ha demostrado que la cistoplastia de aumento se asocia con mejoras en la calidad de vida a pesar de las infecciones urinarias recurrentes en un tercio de los casos, la necesidad de antibióticos profilácticos en un 15% y la necesidad de realizar cateterismo intermitente limpio en el 85% [^176]. Dicho esto, Mundy ha informado tasas de continencia del 93% en pacientes sometidos a aumento de la hiperactividad del detrusor idiopática [^177]. Reportaron índices de cateterismo intermitente limpio de solo 6% en esta población de pacientes.
Pronóstico
Si bien hay muchas publicaciones que detallan el resultado a corto plazo para los niños con disfunción miccional, son muy pocos los que informan los resultados a mediano y largo plazo. Esos estudios, por su naturaleza, tienden a ser transversales más que longitudinales. El proyecto ALSPAC que siguió a una cohorte de nacimientos de 13793 niños seguidos durante 9,5 años informó que la incontinencia urinaria diurna, que era más común en las niñas, disminuyó en prevalencia del 15.5% a los 4.5 años de edad al 4.9% a los 9.5 años de edad [^178] . También encontraron que la prevalencia de enuresis más frecuente (> 2 episodios por semana) se redujo de 1,9% a 0,5% durante el mismo período de tiempo. Hubo una asociación más fuerte con la urgencia en este grupo que también tenían más probabilidades de recibir tratamiento y de permanecer no continentes con el tiempo. El mismo grupo 12 años antes informó sobre la progresión de los síntomas urinarios en la adolescencia de más de 1,000 escolares. Del mismo modo, encontraron que la incontinencia urinaria era más prevalente en las niñas y disminuía con la edad en ambos sexos [^179]. La incontinencia urinaria diurna disminuyó del 16,6% de las niñas de 11-12 años al 4,7% de las de 15-16 años. En los niños, disminuyó del 7,2% al 0,98%. El aumento aparente en la prevalencia del 4,9% a los 9,5 años al 16,6% a los 11-12 años es explicable en gran medida para las diferentes definiciones de incontinencia. De las 25 niñas y 4 niños con enuresis entre los 15 y los 16 años, 10 de las niñas y 3 de los niños tuvieron incontinencia de inicio reciente, que no estaba presente cuando tenían entre 11 y 12 años. Schulman y cols. informaron una curación del 45% (pacientes contienentes, sin medicamentos) después de un mínimo de 6 meses de seguimiento en una cohorte de 222 niños con enuresis diurna [^180]. Se mejoró un 37% adicional (> 50% de reducción en los síntomas) pero posiblemente aún con medicación. El mismo grupo posteriormente publicó sobre un subgrupo de estos pacientes con 6,5 años de seguimiento que informaron una resolución completa del 91% de la enuresis diurna con una mediana de 2,9 años hasta lograr continencia total [^181]. Curiosamente, a pesar del tratamiento integral recibido (que incluía antibióticos, anticolinérgicos, biorretroalimentación y asesoramiento psicológico), los padres consideraron que la maduración era el factor individual más importante en la resolución de los síntomas. En resumen, las tasas de resolución para la incontinencia urinaria diurna es de alrededor del 0,2% por año de vida entre los 7 y los 17 años de edad.
Por supuesto, un pequeño porcentaje no se resuelve y en algunos casos su condición se deteriora. Esto ha sido descrito por algunos como una secuencia miccional disfuncional que a menudo se considera que comienza con hiperactividad del detrusor, que al inducir hiperactividad del esfínter uretral se convierte en micción disfuncional y finalmente termina en un detrusor hipoactivo [^43]. Si esa progresión existe, entonces debería ser evidente en las diferencias de edad entre los diferentes subtipos de disfunción miccional. Hoebeke y cols. reportaron 1000 video-urodinamias realizados en un subconjunto seleccionado de más de 3500 pacientes que se presentaron para la investigación sobre incontinencia durante un período de cuatro años [^71]. De los estudios, el 6,2% fueron normales, el 58% de hiperactividad del detrusor, el 32% de micción disfuncional y el 4% de actividad detrusor o "vejiga perezosa". No hubo evidencia de una secuencia miccional disfuncional de las edades de estos subtipos. Parece que los niños con incontinencia urinaria tienen diferentes patologías primarias.
Resultados a Largo Plazo
Ha habido una serie de estudios (por ejemplo, NOBLE, EPIC, EpiLUTS) que cuantifican la prevalencia y la progresión de la incontinencia urinaria en la edad adulta (182,183). Wennberg y cols. siguieron a un grupo de mujeres seleccionadas al azar de Gotemburgo, Suecia, durante 16 años [^184]. Encontraron una mayor prevalencia de incontinencia urinaria (ver Tabla 6), frecuencia, nicturia y vejiga hiperactiva en aumento con el tiempo. Durante los 16 años transcurridos, el 21% de las mujeres que no estaban con incontinencia urinaria inicialmente la desarrollaron posteriormente. Una porción de tamaño similar (34%) de los que presentaron enuresis inicialmente se volvieron continentes durante ese mismo período. La prevalencia general de vejiga hiperactiva aumentó del 17 al 26% durante el período de 16 años. Todo este aumento fue en aquellas mujeres con incontinencia urinaria ya que la tasa de prevalencia de vejiga hiperactiva seca (es decir, urgencia sin incontinencia) fue del 11% inicialmente y del 10% 16 años después, mientras que para la vejiga hiperactiva húmeda aumentó del 6% inicialmente al 16% más tarde con un incremento en todos los grupos de edad. Muchos otros han informado una progresión y regresión similar de los síntomas de la vejiga hiperactiva en la población adulta a lo largo del tiempo, lo que enfatiza la naturaleza dinámica de la disfunción de LUT [^185].
Tabla 6. Prevalencia de Incontinencia Urinaria
| Edad al Ingreso | 1991 | 2007 | |
|---|---|---|---|
| 20-34 | 6% | 23% | |
| 35-49 | 19% | 28% | |
| 50-64 | 20% | 32% | |
| >65 | 18% | 32% | |
Durante mucho tiempo se sospechó que existe una correlación entre la disfunción miccional de la infancia y los síntomas del tracto urinario inferior en adultos. Actualmente no hay estudios longitudinales que hayan seguido a los niños hasta la edad adulta. La mayoría de los estudios se basan en el recuerdo adulto de los síntomas de la infancia. La asociación conocida entre la incontinencia urinaria adulta y la enuresis nocturna pediátrica se ha discutido en otra parte del capítulo sobre enuresis nocturna. Minassian y cols. informaron que un estudio de control de casos de mujeres adultas remitidas a una clínica de uro-ginecología con incontinencia urinaria no pudo demostrar una mayor probabilidad de micción disfuncional en la infancia [^186]. Descubrieron que el 42% del grupo de control de mujeres adultas asintomáticas también tenía un historial de LUTS infantiles. Sin embargo, cuando combinaron ambos grupos para el análisis de subgrupos, encontraron una correlación significativa entre las mujeres sintomáticas y los LUTS infantiles, y concluyeron que el seguimiento prospectivo de niños sintomáticos hasta la edad adulta podría ser la única forma de responder la pregunta correctamente. Fitzgerald y cols. realizaron una cuestionario a 2109 mujeres seleccionadas al azar, con edades comprendidas entre 40 y 69 años, que encontraron que las mujeres que informaron frecuencia urinaria diurna en la niñez tenían el doble de probabilidades de presentar urgencia urinaria como adultos [^187]. Además, las mujeres con antecedentes de incontinencia urinaria en la infancia tenían 2,6 veces más probabilidades de sufrir incontinencia urinaria en la edad adulta. Estos hallazgos son respaldados por Bower y cols. quienes encontraron que las mujeres adultas que asistían a una clínica de uro-ginecología con síntomas de disfunción de LUT descubrieron que un antecedente de urgencia en la infancia se asociaba con un riesgo 2,3 veces mayor de desarrollar síndrome de eliminación disfuncional en la edad adulta [^188].
Resumen
En conclusión, el tratamiento ideal de los pacientes con disfunción miccional comienza con una historia detallada y específica y un examen físico. Esto se complementa con una investigación apropiada pero no excesiva. El tratamiento comienza con educación y uroterapia en todos los pacientes, antes de una cuidadosa selección de terapias adyuvantes. Es central para padres y pacientes felices que las expectativas sean realistas. La falta de expectativas realistas (y particularmente la creencia en la eficacia de ese tratamiento) contribuye a la tasa de abandono del cumplimiento con la medicación observada en adultos y también en niños (120,189). Con demasiada frecuencia estos niños se presentan al urólogo tardíamente y esperan una "cura" quirúrgica o "solución milagrosa". Podemos ver que ninguna de las terapias analizadas anteriormente tiene una tasa de éxito del 100% y, a medida que se avanza hacia tratamientos más "agresivos", las tasas de éxito disminuyen. Al igual que en el tratamiento de la enuresis nocturna, es probable que se obtenga un mayor éxito a partir de la terapia combinada en lugar de cualquier abordaje individual aislado [^190].
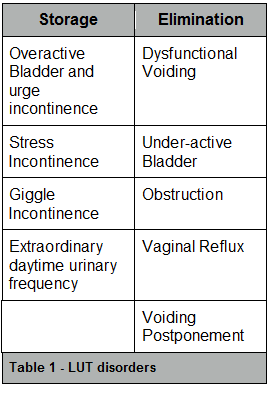
Figura 1. Algoritmo de Disfunción Miccional
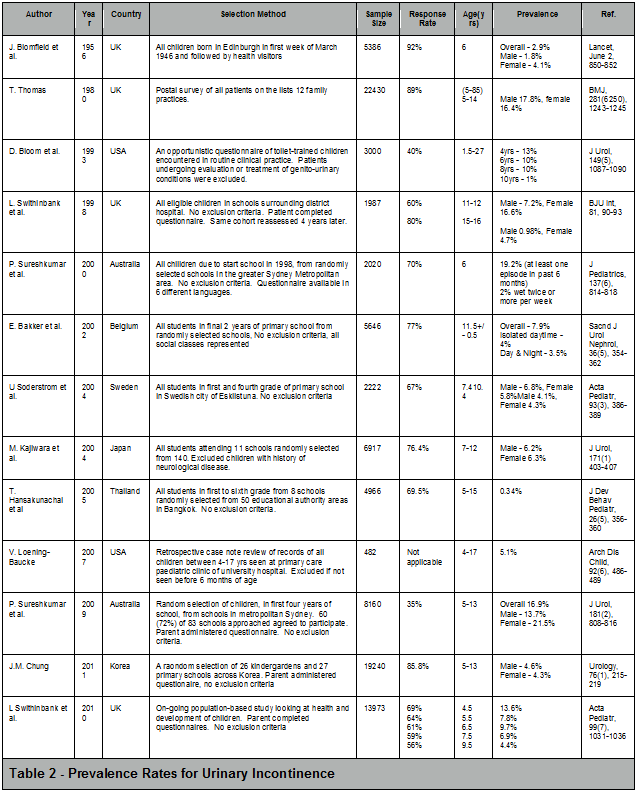
Figura 2.

Figura 3.
Referencias
- Gontard Von A, Hoebeke P, Bauer S, Bower W, Walle JV, Yeung CK, et al. The standardization of terminology of lower urinary tract function in children and adolescents: report from the Standardisation Committee of the International Children's Continence Society. JURO. Elsevier; 2006; 176: 314–24.
- Daly SB, Urquhart JE, Hilton E, McKenzie EA, Kammerer RA, Lewis M, et al. Mutations in HPSE2 Cause Urofacial Syndrome. The American Journal of Human Genetics. 2010 Jun.;86(6):963–9.
- Aitken KJ, Bägli DJ. The bladder extracellular matrix. Part I: architecture, development and disease. Nature Reviews Urology. 2009 Nov.;6(11):596–611.
- Chun SY, Lim GJ, Kwon TG, Kwak EK, Kim BW, Atala A, et al. Identification and characterization of bioactive factors in bladder submucosa matrix. Biomaterials. 2007 Oct.;28(29):4251–6.
- Macarak EJ. Overview of muscle and extracellular matrix in the bladder. Adv. Exp. Med. Biol. 1999; 462: 117–9.
- Msci JQCM. Basic Bladder Neurophysiology. Urologic Clinics of NA. 2010 Nov. 1;37(4):487–94.
- Sillén U, Hjälmås K. Bladder function in preterm and full-term infants–free voidings during four-hour voiding observation. Scand J Urol Nephrol Suppl. 2004; : 63–8.
- Jansson U-B, Hanson M, Hanson E, Hellström AL, Sillen U. Voiding pattern in healthy children 0 to 3 years old: a longitudinal study. JURO. 2000 Dec.;164(6):2050–4.
- Jansson U-B, Hanson M, Sillen U, Hellström AL. Voiding pattern and acquisition of bladder control from birth to age 6 years–a longitudinal study. JURO. 2005 Jul.;174(1):289–93.
- Blum NJ, Taubman B, Nemeth N. Relationship between age at initiation of toilet training and duration of training: a prospective study. PEDIATRICS. 2003 Apr.;111(4 Pt 1):810–4.
- Sillén U. Bladder function in infants. Scand J Urol Nephrol Suppl. 2004; : 69–74.
- deVries MW, deVries MR. Cultural relativity of toilet training readiness: a perspective from East Africa. PEDIATRICS. 1977 Aug.;60(2):170–7.
- Duong TH, Jansson U-B, Holmdahl G, Sillén U, Hellstrom A-L. Development of bladder control in the first year of life in children who are potty trained early. Journal of Pediatric Urology. 2010 Oct. 1;6(5):501–5.
- Sun M, Rugolotto S. Assisted infant toilet training in a Western family setting. J Dev Behav Pediatr. 2004 Apr.;25(2):99–101.
- Bergmann M, Corigliano T, Ataia I, Renella R, Simonetti GD, Bianchetti MG, et al. Childhood extraordinary daytime urinary frequency—a case series and a systematic literature review. Pediatr Nephrol. 2009 Apr. 18;24(4):789–95.
- Dauvilliers Y, Arnulf I, Mignot E. Narcolepsy with cataplexy. Lancet. 2007 Feb. 10;369(9560):499–511.
- Sher PK, Reinberg Y. Successful treatment of giggle incontinence with methylphenidate. JURO. 1996 Aug.;156(2 Pt 2):656–8.
- Dodd ME, Langman H. Urinary incontinence in cystic fibrosis. J R Soc Med. 2005;98 Suppl 45:28–36.
- Franco I. Overactive Bladder in Children. Part 1: Pathophysiology. The Journal of Urology. 2007 Sep.;178(3):761–8.
- Hu T-W, Wagner TH, Bentkover JD, Leblanc K, Zhou SZ, Hunt T. Costs of urinary incontinence and overactive bladder in the United States: a comparative study. Urology. 2004 Mar.;63(3):461–5.
- Chu FM, Dmochowski R. Pathophysiology of overactive bladder. Am. J. Med. 2006 Mar.;119(3 Suppl 1):3–8.
- Brubaker L. Urgency: the cornerstone symptom of overactive bladder. Urology. 2004 Dec.;64(6 Suppl 1):12–6.
- Sackett DL. Bias in analytic research. J Chronic Dis. 1979;32(1-2):51–63.
- Craggs MD. Objective measurement of bladder sensation: use of a new patient‐activated device and response to neuromodulation. BJU Int. Wiley Online Library; 2005; 96: 29–36.
- Kobayashi H, Araki I, Tsuchida T, Zakoji H, Mikami Y, Takeda M, et al. "Urgency tip": a portable patient-activated device for objective measurement of urinary urgency. Urology. 2007 Mar.;69(3):570–1.
- Al-Buheissi S, Khasriya R, Maraj BH, Malone-Lee J. A simple validated scale to measure urgency. The Journal of Urology. 2008 Mar.;179(3):1000–5; discussion1005.
- Chapple CR, Artibani W, Cardozo LD, Castro-Diaz D, Craggs M, Haab F, et al. The role of urinary urgency and its measurement in the overactive bladder symptom syndrome: current concepts and future prospects. BJU Int. 2005 Feb.;95(3):335–40.
- Victor E, OʼConnell KA, Blaivas JG. Environmental Cues to Urgency and Leakage Episodes in Patients With Overactive Bladder Syndrome: A Pilot Study. J Wound Ostomy Continence Nurs. 2012 Mar.;39(2):181–6.
- Bosch JL. The overactive bladder: current aetiological concepts. BJU Int. 1999 Mar.;83 Suppl 2:7–9.
- Griffiths D, Tadic SD. Bladder control, urgency, and urge incontinence: evidence from functional brain imaging. Neurourol. Urodyn. 2008; 27: 466–74.
- Bosch JLHR. Electrical neuromodulatory therapy in female voiding dysfunction. BJU Int. 2006 Sep.;98 Suppl 1:43–8; discussion49.
- Roosen A, Chapple CR, Dmochowski RR, Fowler CJ, Gratzke C, Roehrborn CG, et al. A refocus on the bladder as the originator of storage lower urinary tract symptoms: a systematic review of the latest literature. Eur. Urol. 2009 Nov.;56(5):810–9.
- Gillespie JI. A developing view of the origins of urgency: the importance of animal models. BJU Int. 2005 Sep. 1;96(s1):22–8.
- Drake M, Harvey I, Gillespie J. Autonomous activity in the isolated guinea pig bladder. Experimental physiology. Physiological Soc; 2003; 88: 19–30.
- Fry CH, Sui G-P, Severs NJ, Wu C. Spontaneous activity and electrical coupling in human detrusor smooth muscle: implications for detrusor overactivity? Urology. 2004 Mar.;63(3 Suppl 1):3–10.
- Lewis SA. Everything you wanted to know about the bladder epithelium but were afraid to ask. Am. J. Physiol. Renal Physiol. 2000 Jun.;278(6):F867–74.
- Khandelwal P, Abraham SN, Apodaca G. Cell biology and physiology of the uroepithelium. AJP: Renal Physiology. 2009 Dec.;297(6):F1477–501.
- Michel MC, Chapple CR. Basic mechanisms of urgency: roles and benefits of pharmacotherapy. World J Urol. 2009 Dec.;27(6):705–9.
- Drake MJ. The integrative physiology of the bladder. Ann R Coll Surg Engl. 2007 Sep.;89(6):580–5.
- De Groat WC. The urothelium in overactive bladder: passive bystander or active participant? Urology. 2004 Dec.;64(6 Suppl 1):7–11.
- Wyndaele JJ, Wachter SD. Cystometrical sensory data from a normal population: comparison of two groups of young healthy volunteers examined with 5 years interval. Eur. Urol. Elsevier; 2002; 42: 34–8.
- Gillespie JI, van Koeveringe GA, de Wachter SG, de Vente J. On the origins of the sensory output from the bladder: the concept of afferent noise. BJU Int. 2009 May;103(10):1324–33.
- Feldman AS, Bauer SB. Diagnosis and management of dysfunctional voiding. Current Opinion in Pediatrics. 2006 Apr.;18(2):139–47.
- Allen T. The non-neurogenic neurogenic bladder. JURO. 1977; 117: 232.
- Beer E. Chronic retention of urine in children. Journal of the American Medical Association. Am Med Assoc; 1915; 65: 1709.
- Mosawi Al AJ. Identification of nonneurogenic neurogenic bladder in infants. Urology. 2007 Aug.;70(2):355–6–discussion356–7.
- Vidal I, Heloury Y, Ravasse P, Lenormand L, Leclair M-D. Severe bladder dysfunction revealed prenatally or during infancy. Journal of Pediatric Urology. 2009 Jan. 19;5(1):3–7.
- Sillen U. Bladder dysfunction in children with vesico‐ureteric reflux. Acta Paediatrica. Wiley Online Library; 1999; 88: 40–7.
- Koff SA, Wagner TT, Jayanthi VR. The relationship among dysfunctional elimination syndromes, primary vesicoureteral reflux and urinary tract infections in children. JURO. 1998 Sep.;160(3 Pt 2):1019–22.
- Chen JJ, Mao W, Homayoon K, Steinhardt GF. A multivariate analysis of dysfunctional elimination syndrome, and its relationships with gender, urinary tract infection and vesicoureteral reflux in children. JURO. 2004 May;171(5):1907–10.
- Bael AM, Benninga MA, Lax H, Bachmann H, Janhsen E, De Jong TP, et al. Functional urinary and fecal incontinence in neurologically normal children: symptoms of one 'functional elimination disorder'? BJU Int. 2007 Feb. 1;99(2):407–12.
- Parekh DJ, Pope JC, ADAMS MC, Brock JW. The use of radiography, urodynamic studies and cystoscopy in the evaluation of voiding dysfunction. JURO. 2001 Jan.;165(1):215–8.
- Vincent SA. Postural control of urinary incontinence. The curtsy sign. Lancet. 1966 Sep. 17;2(7464):631–2.
- Duel BP, Steinberg-Epstein R, Hill M, Lerner M. A survey of voiding dysfunction in children with attention deficit-hyperactivity disorder. JURO. 2003 Oct.;170(4 Pt 2):1521–3; discussion1523–4.
- Artibani W, Cerruto MA. The role of imaging in urinary incontinence. BJU Int. Wiley Online Library; 2005; 95: 699–703.
- Martin JL, Williams KS, Abrams KR, Turner DA, Sutton AJ, Chapple C, et al. Systematic review and evaluation of methods of assessing urinary incontinence. Health Technol Assess. 2006 Feb.;10(6):1–132, iii–iv.
- Bright E, Drake MJ, Abrams P. Urinary diaries: evidence for the development and validation of diary content, format, and duration. Neurourol. Urodyn. 2011 Mar.;30(3):348–52.
- Schick E, Jolivet-Tremblay M, Dupont C, Bertrand PE, Tessier J. Frequency-volume chart: the minimum number of days required to obtain reliable results. Neurourol. Urodyn. 2003; 22: 92–6.
- Stone AA, Shiffman S, Schwartz JE, Broderick JE, Hufford MR. Patient non-compliance with paper diaries. BMJ. 2002 May 18;324(7347):1193–4.
- Bright E, Cotterill N, Drake M, Abrams P. Developing a validated urinary diary: Phase 1. Neurourol. Urodyn. 2012 Jan. 24.
- Wallis MC, Khoury AE. Symptom score for lower urinary tract dysfunction in pediatric urology. Curr Urol Rep. 2006 Mar.;7(2):136–42.
- Afshar K, Mirbagheri A, Scott H, MacNeily AE. Development of a symptom score for dysfunctional elimination syndrome. The Journal of Urology. 2009 Oct.;182(4 Suppl):1939–43.
- Arya LA, Banks C, Gopal M, Northington GM. Development and testing of a new instrument to measure fluid intake, output, and urinary symptoms: the questionnaire-based voiding diary. Am. J. Obstet. Gynecol. 2008 May;198(5):559.e1–7.
- Jackson S, Donovan J, Brookes S, Eckford S, Swithinbank L, Abrams P. The Bristol Female Lower Urinary Tract Symptoms questionnaire: development and psychometric testing. Br J Urol. 1996 Jun.;77(6):805–12.
- Brookes ST, Donovan JL, Wright M, Jackson S, Abrams P. A scored form of the Bristol Female Lower Urinary Tract Symptoms questionnaire: data from a randomized controlled trial of surgery for women with stress incontinence. Am. J. Obstet. Gynecol. 2004 Jul.;191(1):73–82.
- Blaivas JG, Panagopoulos G, Weiss JP, Somaroo C, Chaikin DC. The Urgency Perception Score: Validation and Test-Retest. The Journal of Urology. 2007 Jan.;177(1):199–202.
- Chang S-J, Yang SSD. Inter-observer and intra-observer agreement on interpretation of uroflowmetry curves of kindergarten children. Journal of Pediatric Urology. Elsevier Ltd; 2008 Nov. 7;:1–6.
- VENHOLA M, REUNANEN M, TASKINEN S, LAHDES-VASAMA T, UHARI M. Interobserver and Intra-Observer Agreement in Interpreting Urodynamic Measurements in Children. The Journal of Urology. 2003 Jun.;169(6):2344–6.
- Glassberg KI. Evaluating children with nonneurogenic voiding disorders–can we do better? The Journal of Urology. 2008 Oct.;180(4):1226–7.
- Glassberg KI, Combs AJ, Horowitz M. Nonneurogenic Voiding Disorders in Children and Adolescents: Clinical and Videourodynamic Findings in 4 Specific Conditions. JURO. Elsevier Inc; 2010 Nov. 1;184(5):2123–7.
- Hoebeke P, Van Laecke E, Van Camp C, Raes A, Van De Walle J. One thousand video-urodynamic studies in children with non-neurogenic bladder sphincter dysfunction. BJU Int. 2001 Apr.;87(6):575–80.
- Kaufman MR, DeMarco RT, Pope JC, Scarpero HM, Adams MC, Trusler LA, et al. High yield of urodynamics performed for refractory nonneurogenic dysfunctional voiding in the pediatric population. JURO. 2006 Oct.;176(4 Pt 2):1835–7.
- Soygür T, Arikan N, Tokatli Z, Karaboga R. The role of video-urodynamic studies in managing non-neurogenic voiding dysfunction in children. BJU Int. 2004 Apr.;93(6):841–3.
- Pfister C, Dacher JN, Gaucher S, Liard-Zmuda A, Grise P, Mitrofanoff P. The usefulness of a minimal urodynamic evaluation and pelvic floor biofeedback in children with chronic voiding dysfunction. BJU Int. 1999 Dec.;84(9):1054–7.
- Panzera A. Interstitial cystitis/painful bladder syndrome. Urol Nurs. 2007; 27: 13.
- Bird ET, Parker BD, Kim HS, Coffield KS. Caffeine ingestion and lower urinary tract symptoms in healthy volunteers. Neurourol. Urodyn. 2005; 24: 611–5.
- Swithinbank L, Hashim H, Abrams P. The effect of fluid intake on urinary symptoms in women. JURO. 2005 Jul.;174(1):187–9.
- Townsend MK, Resnick NM, Grodstein F. Caffeine intake and risk of urinary incontinence progression among women. Obstet Gynecol. 2012 May;119(5):950–7.
- Jura YH, Townsend MK, Curhan GC, Resnick NM, Grodstein F. Caffeine intake, and the risk of stress, urgency and mixed urinary incontinence. The Journal of Urology. 2011 May;185(5):1775–80.
- Gray M. Caffeine and urinary continence. J Wound Ostomy Continence Nurs. 2001 Mar.;28(2):66–9.
- Subak LL, Whitcomb E, Shen H, Saxton J, Vittinghoff E, Brown JS. Weight loss: a novel and effective treatment for urinary incontinence. JURO. 2005 Jul.;174(1):190–5.
- Hagstroem S, Rittig S, Kamperis K, Djurhuus JC. Timer Watch Assisted Urotherapy in Children: A Randomized Controlled Trial. The Journal of Urology. 2010 Oct.;184(4):1482–8.
- Frewen WK. A reassessment of bladder training in detrusor dysfunction in the female. Br J Urol. 1982 Aug.;54(4):372–3.
- Holmes DM, Stone AR, Bary PR, Richards CJ, Stephenson TP. Bladder training–3 years on. Br J Urol. 1983 Dec.;55(6):660–4.
- Frewen WK. The management of urgency and frequency of micturition. Br J Urol. 1980 Oct.;52(5):367–9.
- Loening-Baucke V. Urinary Incontinence and Urinary Tract Infection and Their Resolution With Treatment of Chronic Constipation of Childhood. PEDIATRICS. 1997 Aug. 1;100(2):228–32.
- Williams CL, Bollella M, Wynder EL. A new recommendation for dietary fiber in childhood. PEDIATRICS. 1995 Nov.;96(5 Pt 2):985–8.
- Castillejo G, Bulló M, Anguera A, Escribano J, Salas-Salvadó J. A controlled, randomized, double-blind trial to evaluate the effect of a supplement of cocoa husk that is rich in dietary fiber on colonic transit in constipated pediatric patients. PEDIATRICS. 2006 Sep.;118(3):e641–8.
- Chung BD, Parekh U, Sellin J. Effect of Increased Fluid Intake on Stool Output in Normal Healthy Volunteers. [Internet]. Journal of Clinical Gastroenterology. 1999 [cited 2012 Apr. 11]. p. 29–32. Available from: http://ovidsp.tx.ovid.com/sp-3.5.1a/ovidweb.cgi?&S=PEBGFPFIFCDDKHAONCALGGDCBDAOAA00&Link+Set=S.sh.15.16.20.24%7c6%7csl_10
- Paré P, Bridges R, Champion MC, Ganguli SC, Gray JR, Irvine EJ, et al. Recommendations on chronic constipation (including constipation associated with irritable bowel syndrome) treatment. Can. J. Gastroenterol. 2007 Apr.;21 Suppl B:3B–22B.
- Tabbers MM, Boluyt N, Berger MY, Benninga MA. Nonpharmacologic treatments for childhood constipation: systematic review. PEDIATRICS. 2011 Oct.;128(4):753–61.
- Wyman JF. Behavioral interventions for the patient with overactive bladder. J Wound Ostomy Continence Nurs. 2005;32(3S):S11.
- Wiener JS, Scales MT, Hampton J, King LR, Surwit R, Edwards CL. Long-term efficacy of simple behavioral therapy for daytime wetting in children. JURO. 2000 Sep.;164(3 Pt 1):786–90.
- KEGEL AH. Progressive resistance exercise in the functional restoration of the perineal muscles. Am. J. Obstet. Gynecol. 1948 Aug.;56(2):238–48.
- Maizels M, King LR, Firlit CF. Urodynamic biofeedback: a new approach to treat vesical sphincter dyssynergia. JURO. 1979 Aug.;122(2):205–9.
- Cammu H, Van Nylen M, Amy JJ. A 10-year follow-up after Kegel pelvic floor muscle exercises for genuine stress incontinence. BJU Int. 2000 Apr.;85(6):655–8.
- Schulman SL, Zuben Von FC, Plachter N, Kodman-Jones C. Biofeedback methodology: does it matter how we teach children how to relax the pelvic floor during voiding? JURO. 2001 Dec.;166(6):2423–6.
- Koenig JF, Mckenna PH. Biofeedback Therapy for Dysfunctional Voiding in Children. Curr Urol Rep. 2011 Apr. 7;12(2):144–52.
- De Paepe H, Hoebeke P, Renson C, Van Laecke E, Raes A, Van Hoecke E, et al. Pelvic-floor therapy in girls with recurrent urinary tract infections and dysfunctional voiding. Br J Urol. 1998 May;81 Suppl 3:109–13.
- Porena M, Costantini E, Rociola W, Mearini E. Biofeedback successfully cures detrusor-sphincter dyssynergia in pediatric patients. JURO. 2000 Jun.;163(6):1927–31.
- Yamanishi T, Yasuda K, Murayama N, Sakakibara R, Uchiyama T, Ito H. Biofeedback training for detrusor overactivity in children. JURO. 2000 Nov.;164(5):1686–90.
- Spettel S, Frawley HC, Blais DR, De E. Biofeedback Treatment for Overactive Bladder. Curr Bladder Dysfunct Rep. 2012 Jan. 6;7(1):7–13.
- Kibar Y, Ors O, Demir E, Kalman S, Sakallioglu O, Dayanc M. Results of biofeedback treatment on reflux resolution rates in children with dysfunctional voiding and vesicoureteral reflux. Urology. 2007 Sep.;70(3):563–6; discussion566–7.
- De Paepe H, Renson C, Hoebeke P, Raes A, Van Laecke E, Vande Walle J. The role of pelvic-floor therapy in the treatment of lower urinary tract dysfunctions in children. Scand. J. Urol. Nephrol. 2002; 36: 260–7.
- Klijn AJ, Uiterwaal CSPM, Vijverberg MAW, Winkler PLH, Dik P, de Jong TPVM. Home uroflowmetry biofeedback in behavioral training for dysfunctional voiding in school-age children: a randomized controlled study. JURO. Elsevier; 2006; 175: 2263–8.
- Mørkved S, Bø K, Fjørtoft T. Effect of adding biofeedback to pelvic floor muscle training to treat urodynamic stress incontinence. Obstet Gynecol. 2002 Oct.;100(4):730–9.
- Kaye JD, Palmer LS. Animated biofeedback yields more rapid results than nonanimated biofeedback in the treatment of dysfunctional voiding in girls. The Journal of Urology. 2008 Jul.;180(1):300–5.
- Kajbafzadeh A-M, Sharifi-Rad L, Ghahestani SM, Ahmadi H, Kajbafzadeh M, Mahboubi AH. Animated biofeedback: an ideal treatment for children with dysfunctional elimination syndrome. The Journal of Urology. 2011 Dec.;186(6):2379–84.
- Barendrecht MM, Oelke M, Laguna MP, Michel MC. Is the use of parasympathomimetics for treating an underactive urinary bladder evidence-based? BJU Int. 2007 Apr.;99(4):749–52.
- Borzyskowski M, Mundy AR, Neville BG, Park L, Kinder CH, Joyce MR, et al. Neuropathic vesicourethral dysfunction in children. A trial comparing clean intermittent catheterisation with manual expression combined with drug treatment. Br J Urol. 1982 Dec.;54(6):641–4.
- Manchana T, Prasartsakulchai C. Bethanechol chloride for the prevention of bladder dysfunction after radical hysterectomy in gynecologic cancer patients: a randomized controlled trial study. Int. J. Gynecol. Cancer. 2011 May;21(4):730–6.
- Canda AE, Cinar MG, Turna B, Sahin MO. Pharmacologic targets on the female urethra. Urol. Int. 2008; 80: 341–54.
- Schwinn DA. The role of alpha1-adrenergic receptor subtypes in lower urinary tract symptoms. BJU Int. 2001 Sep.;88 Suppl 2:27–34; discussion49–50.
- Kinn AC, Lindskog M. Estrogens and phenylpropanolamine in combination for stress urinary incontinence in postmenopausal women. URL. 1988 Sep.;32(3):273–80.
- Hjalmås K, Arnold T, Bower W, Caione P, Chiozza L, Gontard Von A, et al. Nocturnal enuresis: an international evidence based management strategy. JURO. 2004;171(6 Pt 2):2545.
- Van Kerrebroeck P. Duloxetine: an innovative approach for treating stress urinary incontinence. BJU Int. 2004 Jul.;94 Suppl 1:31–7.
- Gras J. Mirabegron for the treatment of overactive bladder. Drugs Today. 2012 Jan.;48(1):25–32.
- Andersson K-E, Yoshida M. Antimuscarinics and the overactive detrusor–which is the main mechanism of action? Eur. Urol. Elsevier; 2003; 43: 1–5.
- Andersson K-E, Appell R, Cardozo LD, Chapple C, Drutz HP, Finkbeiner AE, et al. The pharmacological treatment of urinary incontinence. BJU Int. 1999 Dec.;84(9):923–47.
- Brostrøm S, Hallas J. Persistence of antimuscarinic drug use. Eur. J. Clin. Pharmacol. 2009 Mar.;65(3):309–14.
- Sahai A, Khan MS, Arya M, John J, Singh R, Patel HRH. The overactive bladder: review of current pharmacotherapy in adults. Part 1: pathophysiology and anticholinergic therapy. Expert Opin Pharmacother. 2006 Apr.;7(5):509–27.
- Guay DRP. Clinical pharmacokinetics of drugs used to treat urge incontinence. Clin Pharmacokinet. 2003; 42: 1243–85.
- Chancellor MB, Appell RA, Sathyan G, Gupta SK. A comparison of the effects on saliva output of oxybutynin chloride and tolterodine tartrate. Clin Ther. 2001 May;23(5):753–60.
- Douchamps J, Derenne F, Stockis A, Gangji D, Juvent M, Herchuelz A. The pharmacokinetics of oxybutynin in man. Eur. J. Clin. Pharmacol. 1988; 35: 515–20.
- Getsios D, Caro JJ, Ishak KJ, El-Hadi W, Payne K, O'connel M, et al. Oxybutynin extended release and tolterodine immediate release : a health economic comparison. Clin Drug Investig. 2004; 24: 81–8.
- McCrery RJ, Appell RA. Oxybutynin: an overview of the available formulations. Ther Clin Risk Manag. 2006 Mar.;2(1):19–24.
- Birns J, Lukkari E, Malone-Lee JG. A randomized controlled trial comparing the efficacy of controlled-release oxybutynin tablets (10 mg once daily) with conventional oxybutynin tablets (5 mg twice daily) in patients whose symptoms were stabilized on 5 mg twice daily of oxybutynin. BJU Int. 2000 May;85(7):793–8.
- Diokno AC, Appell RA, Sand PK, Dmochowski RR, Gburek BM, Klimberg IW, et al. Prospective, randomized, double-blind study of the efficacy and tolerability of the extended-release formulations of oxybutynin and tolterodine for overactive bladder: results of the OPERA trial. Mayo Clinic Proceedings. Elsevier; 2003; 78: 687–95.
- Famakinwa O, Chang C, Chung DE. Summary of Anticholinergic Pharmacotherapy Available for Overactive Bladder. Curr Bladder Dysfunct Rep. 2011 Dec. 22;7(1):40–50.
- Sussman D, Garely A. Treatment of overactive bladder with once-daily extended-release tolterodine or oxybutynin: the antimuscarinic clinical effectiveness trial (ACET). Curr Med Res Opin. 2002; 18: 177–84.
- Kaplan SA, Schneider T, Foote JE, Guan Z, Carlsson M, Gong J. Superior efficacy of fesoterodine over tolterodine extended release with rapid onset: a prospective, head-to-head, placebo-controlled trial. BJU Int. 2011 May;107(9):1432–40.
- Chapple CR, Fianu-Jonsson A, Indig M, Khullar V, Rosa J, Scarpa RM, et al. Treatment outcomes in the STAR study: a subanalysis of solifenacin 5 mg and tolterodine ER 4 mg. Eur. Urol. 2007 Oct.;52(4):1195–203.
- Hoebeke P, De Pooter J, De Caestecker K, Raes A, Dehoorne J, Van Laecke E, et al. Solifenacin for Therapy Resistant Overactive Bladder. The Journal of Urology. 2009 Oct.;182(4):2040–4.
- Haab F, Corcos J, Siami P, Glavind K, Dwyer P, Steel M, et al. Long-term treatment with darifenacin for overactive bladder: results of a 2-year, open-label extension study. BJU Int. 2006 Nov.;98(5):1025–32.
- Liu H-T, Kuo H-C. Increased expression of transient receptor potential vanilloid subfamily 1 in the bladder predicts the response to intravesical instillations of resiniferatoxin in patients with refractory idiopathic detrusor overactivity. BJU Int. 2007 Nov.;100(5):1086–90.
- Kessler TM, Bachmann LM, Minder C, Löhrer D, Umbehr M, Schünemann HJ, et al. Adverse Event Assessment of Antimuscarinics for Treating Overactive Bladder: A Network Meta-Analytic Approach. PLoS ONE. 2011 Feb. 23;6(2):e16718.
- Hashim H, Abrams P. Drug treatment of overactive bladder: efficacy, cost and quality-of-life considerations. Drugs. 2004; 64: 1643–56.
- Mangera A, Andersson K-E, Apostolidis A, Chapple C, Dasgupta P, Giannantoni A, et al. Contemporary management of lower urinary tract disease with botulinum toxin A: a systematic review of botox (onabotulinumtoxinA) and dysport (abobotulinumtoxinA). Eur. Urol. 2011 Oct.;60(4):784–95.
- Schurch B, Stöhrer M, Kramer G, Schmid D, Gaul G, Hauri D. Botulinum-A toxin for treating detrusor hyperreflexia in spinal cord injured patients: a new alternative to anticholinergic drugs? Preliminary results. JURO. Elsevier; 2000; 164: 692–7.
- Karsenty G, Denys P, Amarenco G, De Seze M, Gamé X, Haab F, et al. Botulinum toxin A (Botox) intradetrusor injections in adults with neurogenic detrusor overactivity/neurogenic overactive bladder: a systematic literature review. Eur. Urol. 2008 Feb.;53(2):275–87.
- Chancellor MB. Ten years single surgeon experience with botulinum toxin in the urinary tract; clinical observations and research discovery. Int Urol Nephrol. 2010 Jun.;42(2):383–91.
- Gamé X, Khan S, Panicker JN, Kalsi V, Dalton C, Elneil S, et al. Comparison of the impact on health-related quality of life of repeated detrusor injections of botulinum toxin in patients with idiopathic or neurogenic detrusor overactivity. BJU Int. 2011 Jun.;107(11):1786–92.
- Gamé X, Mouracade P, Chartier-Kastler E, Viehweger E, Moog R, Amarenco G, et al. Botulinum toxin-A (Botox) intradetrusor injections in children with neurogenic detrusor overactivity/neurogenic overactive bladder: a systematic literature review. Journal of Pediatric Urology. 2009 Jun.;5(3):156–64.
- Kuo Y-C, Kuo H-C. Botulinum toxin injection for lower urinary tract dysfunction. Int. J. Urol. 2012 May 9.
- Hoebeke P, De Caestecker K, Vande Walle J, Dehoorne J, Raes A, Verleyen P, et al. The effect of botulinum-A toxin in incontinent children with therapy resistant overactive detrusor. JURO. Elsevier; 2006; 176: 328–31.
- Steinhardt GF, Naseer S, Cruz OA. Botulinum toxin: novel treatment for dramatic urethral dilatation associated with dysfunctional voiding. JURO. 1997 Jul.;158(1):190–1.
- Franco I, Landau-Dyer L, Isom-Batz G, Collett T, Reda EF. The use of botulinum toxin A injection for the management of external sphincter dyssynergia in neurologically normal children. JURO. 2007 Oct.;178(4 Pt 2):1775–9–discussion1779–80.
- Petronijevic V, Lazovic M, Vlajkovic M, Slavkovic A, Golubovic E, Miljkovic P. Botulinum toxin type A in combination with standard urotherapy for children with dysfunctional voiding. The Journal of Urology. 2007 Dec.;178(6):2599–602–discussion2602–3.
- Austin PF, Homsy YL, Masel JL, Cain MP, Casale AJ, RINK RC. alpha-Adrenergic blockade in children with neuropathic and nonneuropathic voiding dysfunction. JURO. 1999 Sep.;162(3 Pt 2):1064–7.
- Cain MP, Wu SD, Austin PF, Herndon CDA, Rink RC. Alpha blocker therapy for children with dysfunctional voiding and urinary retention. JURO. 2003 Oct.;170(4 Pt 2):1514–5; discussion1516–7.
- Apostolidis A. Novel insights and targets for managing overactive bladder. The Journal of Urology. 2011 Jun.;185(6):2018–20.
- Elkelini MS, Abuzgaya A, Hassouna MM. Mechanisms of action of sacral neuromodulation. Int Urogynecol J. 2010 Dec.;21 Suppl 2:S439–46.
- Hoebeke P, Van Laecke E, Everaert K. Transcutaneous neuromodulation for the urge syndrome in children: a pilot study. The Journal of …. 2001.
- BARROSO U Jr, LordÊLo PÍC, Lopes AÔNA, Andrade J, MACEDO A Jr, Ortiz V. Nonpharmacological treatment of lower urinary tract dysfunction using biofeedback and transcutaneous electrical stimulation: a pilot study. BJU Int. Wiley Online Library; 2006; 98: 166–71.
- Bower WF, Moore KH, Adams RD. A pilot study of the home application of transcutaneous neuromodulation in children with urgency or urge incontinence. JURO. 2001 Dec.;166(6):2420–2.
- Lordęlo P, Soares PVL, Maciel I, MACEDO A Jr, BARROSO U Jr. Prospective study of transcutaneous parasacral electrical stimulation for overactive bladder in children: long-term results. JURO. Elsevier; 2009; 182: 2900–4.
- Malm-Buatsi E, Nepple KG, Boyt MA, Austin JC, Cooper CS. Efficacy of transcutaneous electrical nerve stimulation in children with overactive bladder refractory to pharmacotherapy. Urology. 2007 Nov.;70(5):980–3.
- Lordêlo P, Teles A, Veiga ML, Correia LC, Barroso U. Transcutaneous electrical nerve stimulation in children with overactive bladder: a randomized clinical trial. The Journal of Urology. 2010 Aug.;184(2):683–9.
- Ozcan J, Ward AR, Robertson VJ. A comparison of true and premodulated interferential currents. YAPMR. Elsevier; 2004; 85: 409–15.
- Chase J, Robertson VJ, Southwell B, Hutson J, Gibb S. Pilot study using transcutaneous electrical stimulation (interferential current) to treat chronic treatment-resistant constipation and soiling in children. J. Gastroenterol. Hepatol. 2005 Jul.;20(7):1054–61.
- Capitanucci ML, Camanni D, Demelas F, Mosiello G, Zaccara A, De Gennaro M. Long-term efficacy of percutaneous tibial nerve stimulation for different types of lower urinary tract dysfunction in children. The Journal of Urology. 2009 Oct.;182(4 Suppl):2056–61.
- De GENNARO M, Capitanucci M, MASTRACCI P, SILVERI M, GATTI C, MOSIELLO G. Percutaneous tibial nerve neuromodulation is well tolerated in children and effective for treating refractory vesical dysfunction. JURO. Elsevier; 2004; 171: 1911–3.
- Hoebeke P, Renson C, Petillon L, Vande Walle J, De Paepe H. Percutaneous electrical nerve stimulation in children with therapy resistant nonneuropathic bladder sphincter dysfunction: a pilot study. JURO. 2002 Dec.;168(6):2605–7–discussion2607–8.
- Humphreys MR, Vandersteen DR, Slezak JM, Hollatz P, Smith CA, Smith JE, et al. Preliminary results of sacral neuromodulation in 23 children. JURO. Elsevier; 2006; 176: 2227–31.
- Roth TJ, Vandersteen DR, Hollatz P, Inman BA, Reinberg YE. Sacral Neuromodulation for the Dysfunctional Elimination Syndrome: A Single Center Experience With 20 Children. The Journal of Urology. 2008 Jul.;180(1):306–11.
- Yamanishi T, Sakakibara R, Uchiyama T, Suda S, Hattori T, Ito H, et al. Comparative study of the effects of magnetic versus electrical stimulation on inhibition of detrusor overactivity. URL. Elsevier; 2000; 56: 777–81.
- But I. Conservative treatment of female urinary incontinence with functional magnetic stimulation. Urology. 2003 Mar.;61(3):558–61.
- Lapides J, Diokno AC, Silber SJ, Lowe BS. Clean, intermittent self-catheterization in the treatment of urinary tract disease. JURO. 1972 Mar.;107(3):458–61.
- Pohl H, Bauer S, Borer J, Diamond D, Kelly M, Grant R, et al. The outcome of voiding dysfunction managed with clean intermittent catheterization in neurologically and anatomically normal children. BJU Int. Wiley Online Library; 2002; 89: 923–7.
- Liard A, Séguier-Lipszyc E, Mathiot A, Mitrofanoff P. The Mitrofanoff procedure: 20 years later. JURO. 2001 Jun.;165(6 Pt 2):2394–8.
- Clark T, Pope JC, Adams MC, Wells N, Brock JW. Factors that influence outcomes of the Mitrofanoff and Malone antegrade continence enema reconstructive procedures in children. JURO. 2002 Oct.;168(4 Pt 1):1537–40–discussion1540.
- Thomas JC, Dietrich MS, Trusler L, DeMarco RT, Pope JC, Brock JW, et al. Continent catheterizable channels and the timing of their complications. JURO. 2006 Oct.;176(4 Pt 2):1816–20–discussion1820.
- Novak TE, Salmasi AH, Mathews RI, Lakshmanan Y, Gearhart JP. Complications of complex lower urinary tract reconstruction in patients with neurogenic versus nonneurogenic bladder–is there a difference? The Journal of Urology. 2008 Dec.;180(6):2629–34–discussion2634–5.
- CHAPPLE CR, Bryan NP. Surgery for detrusor overactivity. World J Urol. 1998; 16: 268–73.
- Reyblat P, Ginsberg DA. Augmentation enterocystoplasty in overactive bladder: is there still a role? Curr Urol Rep. 2010 Nov.;11(6):432–9.
- Hasan ST, Marshall C, Robson WA, Neal DE. Clinical outcome and quality of life following enterocystoplasty for idiopathic detrusor instability and neurogenic bladder dysfunction. Br J Urol. 1995 Nov.;76(5):551–7.
- Venn SN, Mundy AR. Long-term results of augmentation cystoplasty. Eur. Urol. 1998;34 Suppl 1:40–2.
- Swithinbank LV, Heron J, Gontard Von A, Abrams P. The natural history of daytime urinary incontinence in children: a large British cohort. Acta Paediatrica. 2010 Jul.;99(7):1031–6.
- Swithinbank L, Brookes S, Shepherd A, Abrams P. The natural history of urinary symptoms during adolescence. BJU Int. Wiley Online Library; 1998; 81: 90–3.
- Schulman SL, Quinn CK, Plachter N, Kodman-Jones C. Comprehensive management of dysfunctional voiding. PEDIATRICS. American Academy of Pediatrics; 1999; 103: e31–1.
- Saedi NA, Schulman SL. Natural history of voiding dysfunction. Pediatr Nephrol. 2003 Sep.;18(9):894–7.
- Milsom I, Irwin DE. A cross-sectional, population-based, multinational study of the prevalence of overactive bladder and lower urinary tract symptoms: results from the EPIC study. European Urology Supplements. Elsevier; 2007; 6: 4–9.
- Coyne KS, Sexton CC, Thompson CL, Milsom I, Irwin D, Kopp ZS, et al. The prevalence of lower urinary tract symptoms (LUTS) in the USA, the UK and Sweden: results from the Epidemiology of LUTS (EpiLUTS) study. BJU Int. 2009 Aug.;104(3):352–60.
- Wennberg A-L, Molander U, Fall M, Edlund C, Peeker R, Milsom I. A longitudinal population-based survey of urinary incontinence, overactive bladder, and other lower urinary tract symptoms in women. Eur. Urol. 2009 Apr.;55(4):783–91.
- Irwin DE, Milsom I, Chancellor MB, Kopp Z, Guan Z. Dynamic progression of overactive bladder and urinary incontinence symptoms: a systematic review. Eur. Urol. 2010 Oct.;58(4):532–43.
- Minassian VA, Lovatsis D, Pascali D, Alarab M, Drutz HP. Effect of childhood dysfunctional voiding on urinary incontinence in adult women. Obstet Gynecol. 2006 Jun.;107(6):1247–51.
- Fitzgerald MP, Thom DH, Wassel-Fyr C, Subak L, Brubaker L, Van Den Eeden SK, et al. Childhood urinary symptoms predict adult overactive bladder symptoms. JURO. 2006 Mar.;175(3 Pt 1):989–93.
- Bower W, Yip S, Yeung C. Dysfunctional elimination symptoms in childhood and adulthood. JURO. Elsevier; 2005; 174: 1623–8.
- Renganathan A, Robinson D, Cardozo L, Srikrishna S, Cartwright R. Do women with overactive bladder have realistic expectations for therapy? Int Urogynecol J. 2010 Apr.;21(4):409–14.
- Wyman JF, Burgio KL, Newman DK. Practical aspects of lifestyle modifications and behavioural interventions in the treatment of overactive bladder and urgency urinary incontinence. International Journal of Clinical Practice. 2009 Aug.;63(8):1177–91.









