Anomalías de la unión ureterovesical (UUV)
Marie-Klaire Farrugia, MD (Res) FRCSEd (Paed Surg)
Traducido y editado desde el original al español | Enlace a la versión en inglés
Dra Cinthia Galvez Alegria, Dr. Miguel Castellan
Miami Children's Hospital, Jackson Memorial Hospital, Miami, Fl, USA
Introducción
Laa anomalías de la unión ureterovesical (UUV) fueron clasificadas por Smith et al.1 en obstructivas, reflujante o, no obstructivo/no reflujante y; subdivididas en primarios (congénitos) o secundarios (adquiridos).2, más tarde publicó una clasificación más práctica: obstructivo, reflujante, no obstructivo/no reflujante y , obstructivo y reflujante. Las anomalías congénitas de UUV a menudo se presentan debido a la detección de un uréter dilatado o megaureter (Fig. 1). Los megauréteres primario congénitos son dos veces más comunes en los hombres y se presentan con una relación de izquierda a derecha de 1.8:1.3 El enfoque de este capítulo será sobre el megaureter obstructivo y el no obstructivo/no reflujante.
Embriología y genética de la unión ureterovesical
Las anomalías UUV forman parte de las anomalías congénitas del riñón y tracto urinario (CAKUT). Brevemente, CAKUT incluye un espectro de anomalías que afectan la formación del tracto urinario, incluyendo agenesia renal, displasia o hipoplasia; obstrucción ureteral proximal o distal (unión ureteropélvica UUP u, obstrucción UUV); dilatación del uréter (megauréter); incompetencia uretérica (reflujo vesicouretérico) y obstrucción uretral (por ejemplo, debido a válvulas uretrales posteriores o atresia uretral).4 Desde el punto de vista embriológico, el riñón de los mamíferos se deriva de dos componentes: la yema ureteral, un epitelio que se ramifica de forma recurrente para formar los conductos colectores y el mesénquima metanéfrico. La yema ureteral también da lugar al epitelio de la pelvis renal y el uréter, que se conoce como el urotelio.5
Hasta la fecha, nuestro conocimiento del desarrollo ureteral normal se limita a lo que hemos aprendido de modelos animales como los ratones transgénicos con fenotipos renales/ureterales anormales. Estos estudios sugieren que varios genes, factores de transcripción, así como proteínas secretadas, contribuyen al desarrollo ureteral normal, y cuando se alteran, manifiestan varias formas de CAKUT. Un factor clave en el desarrollo uretérico es el factor neurotrófico derivado de la línea celular glial y la proteína c-ret tirosina quinasa transmembrana (GDNF / c-ret) axis 4. El brote y ramificación de los brote ureteral depende de la interacción entre el GDNF y su co-receptor del co-receptor 1 glicosil-fosfaditylinositol (Gfrα1), que se une y activa al c-ret. GDNF se expresa principalmente en el mesénquima metanéfrico, la cuña trigonal del uréter distal y el seno urogenital. En mutaciones c-ret - / - se observaron agenesia renal, hipodisplasia severa y uréteres de terminación ciega. También se encontró que mutaciones GDNF - / - y Gfrα1 - / - tienen fenotipos similares, lo que sugiere que el eje GDNF-c-ret es necesario para el inicio de brotes ureterales y la morfogénesis de ramificación temprana.6
La expresión de C-ret es dependiente del ácido retinoico (un metabolito de la vitamina A). Batourina et al mostraron que la vitamina A y el protooncogén Ret son necesarios para la formación de una conexión adecuada entre la vejiga y el uréter.7 Los mutantes de ratón que carecen de Ret o Rara y Rarb , dos miembros de la familia del receptor retinoide, tenían hidronefrosis y megauréter, ambos vinculados a defectos en etapas tempranas de la maduración del uréter, cuando "conducto nefrítico común" (CND, el nombre dado por Batourina et al. En la parte del conducto mesonéfrico proximal al origen de la yema uretérica, la remodelación induce a los orificios uretéricos a separarse de los conductos mesonéfricos. Sus estudios sugieren que la vitamina A y Ret fueron requeridos para la expansión de la CND en una estructura llamada cuña, que propusieron era el precursor probable del trígono. Sin embargo, sus experimentos posteriores desafiaron la explicación tradicional para el modo de inserción del uréter en la vejiga.8 El modelo tradicional de maduración del uréter sugiere que el orificio uretérico se transpone desde su ubicación inicial al final de la CND hasta el seno urogenital, que se diferencia en la vejiga y la uretra. El conducto nefrítico común se integra en el seno urogenital, formando el trígono y reposicionando los uréteres y el conducto mesonéfrico en el proceso.9,10. Sin embargo, Batourina et al mostró que la CND no se diferencia en el trígono, sino que sufre apoptosis.7
En lugar de diferenciarse en el trígono, la cuña puede ser una estructura transitoria que se forma a medida que la CND sufre una remodelación y luego regresa. La señalización de la vitamina A es necesaria tanto para la diferenciación del seno urogenital como para la generación de señales que controlan la apoptosis de la CND.8 Por otra parte, el trígono se forma principalmente a partir del músculo liso de la vejiga, con una contribución menor del uréter.11 Aunque una explicación para el desarrollo anormal de la unión ureterovesical no está bien definida, parece probable que un desarrollo aberrante de esta vía pueda estar implicado.El momento de la diferenciación del músculo liso en el uréter distal es desconocido, pero puede ser clave para comprender por qué el reflujo o la obstrucción se desarrollan en el ureter, persisten en el recién nacido y disminuyen más tarde en la infancia. Pirker et al estudiaron muestras de vejiga en fetos porcinos, lechones recién nacidos y de 6 meses de edad.12 Encontraron que, a los 60 días, el músculo detrusor de la vejiga estaba bien desarrollado e inervado, mientras que el uréter intra y extra-vesical acababa de comenzar a diferenciarse. En el día 90, el uréter extravesical estaba bien inervado, pero el uréter intra-vesical no maduró hasta después del nacimiento. Todos los componentes del músculo liso mostraron un aumento sorprendente en el volumen entre las secciones neonatales y posteriores. El curso temporal del desarrollo muscular en este estudio se correlaciona con los hallazgos en humanos, en los que fibras de músculo liso del uréter extramural aparecen por primera vez en las semanas 17 a 22 de gestación, y el desarrollo del músculo ureteral se desarrolla en una dirección craneocaudal.13
Los autores también notaron que el desarrollo de la vaina periureteral precede al desarrollo del músculo liso ureteral, que también fue reportado en humanos. La vaina periureteral mostró un desarrollo neuromuscular postnatal considerable. Sus fibras musculares crecieron significativamente y casi formaron una capa continua a los 6 meses 12. Tanagho, también observó que el uréter distal es la última parte en desarrollar su cubierta muscular, y que la diferenciación muscular temprana es principalmente de los músculos circulares.14 El proceso mediante el cual el patrón muscular circular, que es típico del uréter fetal, cambia progresivamente a las capas musculares dobles del infante a término, muchos otros estudios han sugerido posibles explicaciones para el desarrollo de la obstrucción por UUV. Estos incluyen un aumento del músculo alrededor de la porción distal del uréter, un aumento de las fibras de colágeno y una desregulación de la neuromodulacion en el segmento yuxtavesical del megaureter obstruido.15,16,17 Payabvash et al estudiaron una serie de uréteres obstruidos en pacientes de entre 6 meses y 2 años de edad, y mostraron la presencia de un aumento de la apoptosis de los miocitos, una reducción de los elementos vasculares y neurales, asociados con un aumento de las fibras de colageno.18 Curiosamente, Kang et al mostraron que hay diferencias significativas en el número de células musculares lisas, índices de apoptosis de los miocitos y el número de células de tipo Cajal C-kit positivas, entre los subgrupos obstructivo y con reflujo.19 Puede durar hasta dos años y puede explicar las alteraciones funcionales transitorias de la UUV durante este período.
Diagnóstico prenatal
En la mayoría de los centros del Reino Unido, las estudios prenatales se realizan de forma rutinaria a las 12 semanas (exploración de "citas") y de 18 a 20 semanas (exploración de "anomalía"). Se realizan exploraciones adicionales más adelante en el embarazo cuando está indicado, como en casos de dilatación del tracto superior, hidronefrosis bilateral, vejiga de pared gruesa o presencia de oligohidramnios. Los datos de una gran base de datos europea para la vigilancia de malformaciones congénitas (EUROCAT) recopilada durante un período de diez años dieron una prevalencia general de hidronefrosis congénita de 11,5 por cada 10.000 nacimientos.20 El 73% de los casos fueron diagnosticados prenatalmente, y el 72% fueron hombres. No se conoce la proporción de estos casos que también tenían un uréter dilatado. La detección de un uréter dilatado en ultrasonido fetal puede ser una tarea difícil. El feto puede no estar en la orientación adecuada, o el uréter puede estar oculto por estructuras superpuestas o gases intestinales maternos. Además, es posible que los técnicos no estén capacitados para buscar específicamente los uréteres dilatados en el examen de rutina. Como resultado, es probable que la detección prenatal de uréteres dilatados no sea confiable.3 En un estudio de 101 pacientes con hidroureteronefrosis identificada postnatalmente referida al Hospital Great Ormond Street, solo el 20% tenía un uréter dilatado documentado prenatalmente.3 Cuarenta y ocho (47,5%) de los bebés tenían RVU u otra patología, y 53 (52,5%) eran sospechosos de tener una obstrucción de la UUV.
Investigación postnatal
Después del nacimiento, a los bebés con diagnóstico prenatal de hidronefrosis suelen ser iniciados con profilaxis antibiótica, hasta que tener un diagnóstico definitivo. La investigación inicial consiste en una ecografía del tracto renal, que se realiza idealmente entre los días 3 y 7 de la vida. Los niños con hidronefrosis bilateral deben ser cateterizados y obtener una ecografía y cistouretrograma de evacuación (VCUG) para excluir la obstrucción de la salida de la vejiga (BOO), como las válvulas uretrales posteriores, y / o identificar el RVU bilateral. En ausencia de obstrucción uretral, después de las 4 semanas de edad, debe realizarse una renografía diurética con 99mTc-MAG-3 y una nueva ecografía. En presencia de dilatación unilateral (Fig. 2 y 3), se realiza una ecografía, una renografía diurética MAG-3 y un VCUG entre las cuatro semanas y los tres meses de edad.
Los bebés que se presentan postnatalmente (por ejemplo, por una infección del tracto urinario) también se investigan de manera similar, aunque es aconsejable esperar la recuperación de la urosepsis antes de embarcarse en un MCUG o MAG-3.
De acuerdo con las directrices de la Asociación Europea de Medicina Nuclear (EANM) para la renografía estándar y diurética en niños, la renografía permite la estimación de dos aspectos de la función renal.21 El primer aspecto es el aclaramiento renal o la función renal diferencial (DRF). La estimación de DRF se realiza mejor entre uno y dos minutos después de la inyección del marcador. El segundo aspecto es la excreción o desaparición del marcador del riñón. Tradicionalmente, un retraso importante en la excreción es sugerido por una curva continuamente ascendente y un tránsito retardado, es decir, un Tmax (es decir, el tiempo para alcanzar el máximo, o pico, de la curva) durante 20 minutos (Fig. 4a y b). Sin embargo, el tránsito retrasado puede ser causado por el aumento de la capacidad que ofrece una pelvis y un uréter dilatados per se. Por lo tanto, la furosemida se administra para aumentar el flujo de orina en un intento de distinguir entre drenaje bueno, intermedio y deficiente.22 El drenaje deficiente también puede ser evidente porque la vejiga está llena, o porque el efecto de la gravedad sobre el drenaje es incompleto. Por todas estas razones, la interpretación de "drenaje deficiente" en la renografía diurética es controvertida. El seguimiento a largo plazo ha demostrado que, en los renogramas diuréticos secuenciales, puede haber DRF estable y tamaño de la pelvis renal, pero el drenaje a menudo se ve alterado en diversos grados.22 Esta observación clínica sugiere que solo cuando hay una disminución en la función renal y / o dilatación progresiva de la pelvis renal, se puede suponer que el deterioro renal progresivo ha comenzado.22
Por lo tanto, se debe tener en cuenta una combinación de hallazgos clínicos y radiológicos al etiquetar un megauréter como "obstruido" o "no obstruido". La presencia de síntomas, como infección febril del tracto urinario o dolor, son indicadores clínicos de un problema dentro del sistema. En el paciente asintomático, la presencia de un DRF por debajo del 40% y / o el aumento de la dilatación en las ecografías seriadas también sugieren obstrucción e indicaciones para la intervención. El tránsito demorado en MAG-3 en presencia de dilatación estable o en mejoría, y un DRF por encima del 40% en un paciente asintomático, no es un indicador fuerte de obstrucción, aunque estaría indicado un seguimiento continuo. Liu et al y McLellan et al, sugirieron que los niños con un diámetro ureteral retrovesical mayor de 10 mm tenían más probabilidades de requerir intervención quirúrgica.3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23
Es importante tener en cuenta que la obstrucción ipsilateral UUP y UUV puede coexistir. El MAG-3 preoperatorio puede sugerir una patología dual cuando el uréter obstruido se llena pero no se drena, ya que la pelvis obstruida se drena lentamente. Cay et al, informaron que un pielograma retrógrado fue útil para hacer un diagnóstico en aquellos casos que se sospechaban antes de la operación.24 La mayoría de los pacientes en su serie de casos, sin embargo, solo eran sospechosos de tener ambos OUUV y OUUP cuando se descubrió un uréter dilatado en la pieloplastia, y después de dificultades para insertar un stent más allá de la UVJ. Un nefrostograma postoperatorio confirmó el diagnóstico.
Manejo
La tendencia en el manejo de los megaureteres primarios ha cambiado en los últimos veinte años. En 1989, Peters et al. informaron que el 89% de los pacientes requirieron cirugía antes de los 8 meses de edad.25 Ese mismo año, Keating et al., informaron que cuando la decisión de intervenir se basaba en la función renal absoluta, se podía realizar un seguimiento conservador de hasta el 87% de los pacientes.26 Otra publicación de la misma unidad confirmó la estabilidad o la mejoría en el seguimiento a largo plazo del mismo grupo de pacientes que tuvieron un manejo conservador.27 Liu et al, también sugirieron que la mayoría de los megaureteres pueden ser seguidos de forma conservadora, y mostraron que con un seguimiento promedio de 3,1 años, el 34% de los megaureteres primarios se resolvieron espontáneamente. De los casos restantes, el 17% se reimplantó debido a infección o deterioro de la función renal, mientras que el 49% tuvo una dilatación persistente en el seguimiento y todavía se estaba controlando de forma conservadora.
Megaureteres sin reflujo no obstruidos
Los megaureteres asociados con un DRF > 40% en un paciente asintomático se pueden manejar de forma conservadora. El seguimiento cercano (cada 3-4 meses) con ultrasonido y la profilaxis con antibióticos están garantizados durante al menos el primer año de vida, especialmente en casos con dilatación significativa (> 1 cm de diámetro ureteral).3,4,5,6,7,8,9,10,11,12,13,14,15,16,17,18,19,20,21,22,23 Song et al, 8 mostraron que el riesgo de ITU es mayor con la obstrucción UUV que con la UUP, y que las ITU tienden a ocurrir dentro de los primeros seis meses de vida.8 Una vez que se observa que la hidronefrosis está mejorando, las citas de seguimiento pueden reducirse a seis meses y luego al año, y se debe suspender la profilaxis con antibióticos. A una mediana de seguimiento de 25,8 meses, McLellan et al mostraron que la hidronefrosis se había resuelto completamente en el 72% de los casos.27. Los niños con megauréter persistente al final del estudio observaron una disminución significativa en el grado de hidronefrosis, lo que sugiere un proceso dinámico con una tendencia hacia la resolución. Los autores también sugirieron que el grado de hidronefrosis a la presentación según la clasificación de la Society of Fetal Urology (SFU) tuvo un efecto significativo en la edad media de resolución (la Tabla 1 resume los grados de SFU de hidronefrosis). Los megauréteres con grados 1 a 3 de hidronefrosis en el momento del diagnóstico se resolvieron entre los 12 y 36 meses de edad. Los grados 4 a 5 de hidronefrosis tardaron más tiempo en resolverse, hasta 72 meses.23
Sin embargo, no hay evidencia de que la resolución sea permanente, y estudios recientes sugieren que el seguimiento debe continuar en la vida adulta. Un estudio de seguimiento a largo plazo realizado por Shukla et al, informaron deterioro tardío en un niño de 14 años con megauréteres primarios bilaterales, que se presentó con mayor dilatación y deterioro funcional seis años después de haber sido dado de alta del seguimiento conservador.28 Aún más alarmante es el estudio de Hemal et al, que informó el resultado de 55 pacientes con megauréteres congénitos que se presentaron por primera vez en la tercera década de la vida, de los cuales se encontró que 20 pacientes tenían cálculos renales.29 Cinco pacientes con megauréteres bilaterales se encontraban en insuficiencia renal crónica en el momento del diagnóstico, de los cuales dos eventualmente murieron de la enfermedad. Por lo tanto, una resolución temprana después de un manejo conservador no es una garantía de por vida, y es recomendable un seguimiento en la edad adulta.
Megauréteres obstruidos (obstrucción UUV)
El megauréter obstruido requiere intervención quirúrgica para preservar la función renal. Aunque en la mayoría de los casos, la intervención definitiva es la reimplantación ureteral, se han propuesto otras intervenciones como medidas temporales. Éstos incluyen:
- Stenting temporal con JJ
- Dilatación endoscópica con balón.
- Endoureterotomía
- Ureterocistotomía reflujante
- Ureterostomía cutánea
Reimplantación ureteral
Peters et al demostraron que la reparación de un megauréter obstruido en la infancia temprana mejora el drenaje renal según lo evaluado por la urografía excretora y, por lo tanto, ofrece la posibilidad de prevenir el daño renal antes del desarrollo de síntomas o la disminución de la función en el renograma.30 La reimplantación uretérica permite la extirpación del segmento angosto y aperistáltico, y el uréter se canaliza hacia la vejiga en forma de antirreflujo. El túnel debe tener al menos cinco veces el diámetro ureteral para ser efectivo datos basados en un estudio realizado por Paquin en 1959.31 Para obtener esta relación cuando el diámetro ureteral es superior a 10 mm, es posible que se necesiten los 10 cm distales del uréter deban ser modelados. También se puede requerir un enganche en el psoas para asegurar una entrada directa del uréter en la vejiga. Los 2 tipos de técnicas de modelaje ureteral más comunenmente utilizados son de tipo plicatura reportados por Starr, y Kalicinski_; y el modelaje ureteral modificado por Hendren.32,33,34 Kalicinski et al describió una técnica de plegado mediante la cual la parte lateral avascular del uréter se excluyó de la luz mediante una sutura continua longitudinal y luego se dobla por la parte posterior antes de la reimplantación.33 Starr, modificó este procedimiento, introduciendo muchas suturas de Lembert interrumpidas que doblan la pared ureteral hacia adentro y suturando el uréter en dos capas, preservando así su suministro de sangre pero haciendo la reimplantación más incómoda.34. Ben-Meir et al., compararon el resultado de la reimplantación de megauréteres con y sin modelaje, y reportaron que no hubo diferencias significativas en el resultado (94% de tasa de éxito en el grupo con modelaje y 96% en el grupo sin).35 Las técnicas de reimplantación intravesical (Cohen y Leadbetter-Politano) son preferibles para algunos autores cuando el uréter va a modelar, especialmente en niños mayores con un grado de disfunción de la vejiga.36 También se han descrito técnicas de reimplante con modelaje ureteral laparoscópica y robótica, aunque se esperan resultados a largo plazo.37,38
La reimplantación ureteral en bebés menores de un año de edad puede ser difícil debido a la discrepancia entre el uréter con dilatación gruesa y la vejiga infantil pequeña, y la preocupación por la posible disfunción de la vejiga en forma iatrogénica. De Jong, investigó el resultado funcional de la vejiga de 49 recién nacidos y lactantes con megauréteres obstructivos o de reflujo primarios, que se sometieron a un procedimiento Politano Leadbetter, con un seguimiento promedio de 7,3 años.39 No se observó una disfunción miccional en el seguimiento, y la capacidad de la vejiga para la edad aumentó significativamente. No se observó obstrucción ureteral postoperatoria. El autor concluyó que las reconstrucciones del tracto urinario inferior en niños pequenos no dañan las propiedades urodinámicas de la vejiga y el suelo pélvico, siempre que la cirugía sea realizada por cirujanos urólogos pediátricos especializados. Un estudio adicional del mismo grupo comparó el resultado urodinámico en pacientes que se sometieron a una reimplantación ureteral antes o después de un año de edad.40 No se encontraron diferencias significativas en la capacidad de la vejiga, el cumplimiento o la incidencia de inestabilidad.
Procedimientos endoscópicos
En 1999, Shenoy y Rance reportaron el uso de los stent en doble J como una medida temporal en infantes con megauréteres obstructivos primarios.41 El procedimiento consiste en la inserción endoscópica de un catéter doble J, 4.7 o 5.2 Fr cuando este sea posible. Una severa obstrucción de la UUV puede impedir la inserción endoscópica, en cuyo caso se puede realizar una inserción abierta a través de una cistostomía combinada con la dilatación del orificio ureteral utilizando una sonda lagrimal. Los stents pueden permanecer in situ durante seis meses, después de lo cual, deben retirarse o reemplazarse. El stent debe colocarse en el megauréter hasta que el bebé tenga más de un año de edad, momento en el cual se puede realizar un reimplante ureteral de forma segura.42 El bebé debe seguir tomando antibióticos profilácticos mientras el stent está in situ, debido al riesgo de infección del stent; y debe controlarse mediante ecografía para garantizar la descompresión del sistema y verificar la posición del stent. Una ecografía y una renografía MAG-3 realizadas tres meses después de la extracción del stent dirigirán el manejo adicional. En presencia de una mejor dilatación y drenaje, y de una función preservada, no se requiere intervención adicional.42 La dilatación persistente o que empeora después de un período de colocación de stent, o una infección adicional, es una indicación de reimplante ureteral. Un estudio de resultados a largo plazo reveló que en el 56% de los casos, no se requirió intervención adicional después de la extracción del stent.42 Sin embargo, dos tercios de los pacientes requirieron la inserción de un stent abierto, y un tercio sufrió complicaciones (migración, formación de cálculos e infección).
Angerri et al publicaron su experiencia con la dilatación con balón endoscópica utilizando un balón de dilatación 4 F insuflado a 12-14 atm durante 3-5 minutos.43 La desaparición del anillo estrecho se verificó radiológicamente. Un stent dobleJ se dejó in situ durante dos meses. De siete pacientes, el drenaje postoperatorio mejoró en cinco pacientes después de una dilatación, y en un paciente adicional después de dos dilataciones. Sin embargo, el seguimiento fue breve y el resultado a largo plazo no se conoce.
Kajbafzadeh et al describieron un procedimiento de endoureterotomía en pacientes con "obstrucción ureteral intravesical" y una longitud de estenosis <1,5 cm.44 Su serie de casos de 47 pacientes incluye bebés de hasta 1,5 meses, aunque la edad media de intervención fue de 3,7 años. Los autores informaron una impresionante tasa de éxito del 90% en un seguimiento medio de 39 meses, incluida la resolución completa del 71% de la hidronefrosis, con la hematuria autolimitada como la única complicación.
Procedimientos temporales
Las medidas temporales incluyen el reimplante ureteral reflujante, descrito por Lee et al donde el uréter proximal a la obstrucción se anastomosa a la cúpula de la vejiga en una forma de reflujo libre, convirtiendo así la obstrucción "peligrosa" en el mal menor que es reflujo.45 Una ureterostomía cutánea temporal es una opción alternativa, aunque no sin sus complicaciones, que incluyen estenosis de estoma y pielonefritis.46
Conclusión
Las anomalías de UUV pueden ser obstructivas, reflujantes, no obstructivas - no reflujantes, u obstructivo y reflujante. Todos los tipos de anomalías congénitas de UUV pueden asociarse con un uréter dilatado o "mega", por lo que se requiere una evaluación cuidadosa del paciente, combinado con una investigación radiológica, para identificar megauréteres "obstruidos" que requieren intervención quirúrgica. Solo el 10-20% de los megauréteres requieren intervención, mientras que el resto se puede monitorear de forma conservadora. Las opciones quirúrgicas incluyen reimplante ureteral, con o sin adaptación ureteral, procedimientos endoscópicos o medidas temporales como una ureterostomía cutánea o ureteroneocistostomía reflujante.
Figuras
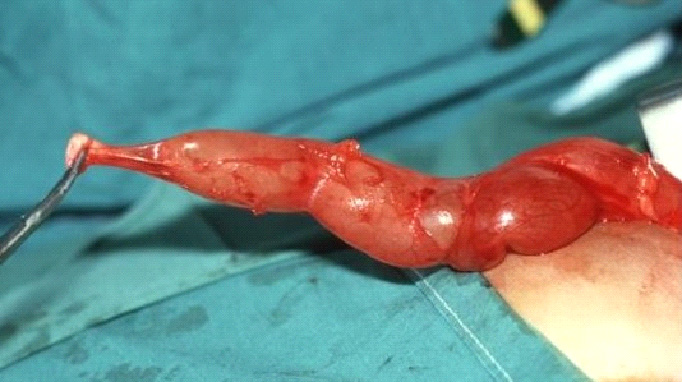
Figura 1. Vista intraoperatoria de un megauréter y un segmento yuxta-vesical (AS) estrecho y angosto.
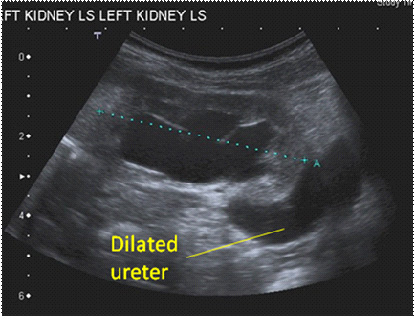
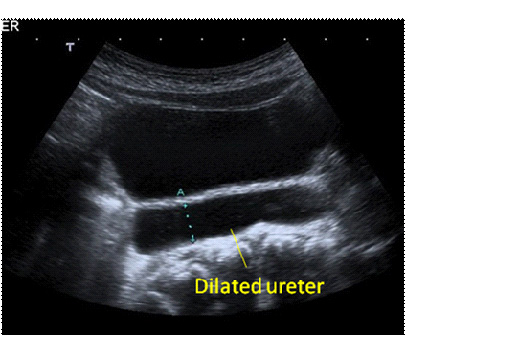
Figuras 2 y 3. Aparición ecográfica de un uréter dilatado proximal (a) y distal detrás de la vejiga (b)
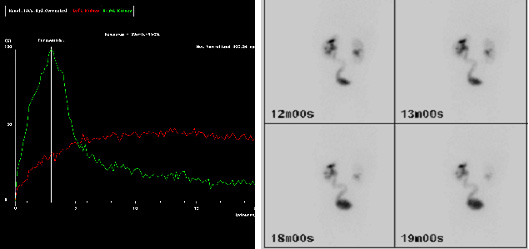
Figura 4a y b. Imágenes MAG-3 que muestran el drenaje retardado del marcador (curva roja) a los 20 minutos (a) y el uréter izquierdo visible (L) en la imagen tardía (b), lo que sugiere un bloqueo en el UUV
Referencias
-
Smith ED. Report of Working Party to establish the international nomenclature for the large ureter. In: Bergsma D, Duckett JW, editors. Birth Defects. Original articles series. 13 ed. 1977 p. 3-8. ↩
-
King LR. Megaloureter: definition, diagnosis and management. J Urol 1980; 123: 222-223. ↩
-
Liu HY, Dhillon HK, Yeung CK, Diamond DA, Duffy PG, Ransley PG. Clinical outcome and management of prenatally diagnosed primary megaureters. J Urol 1994; 152(2 Pt 2):614-617. ↩ ↩2 ↩3 ↩4 ↩5
-
Stahl DA, Koul HK, Chacko JK, Mingin GC. Congenital anomalies of the kidney and urinary tract (CAKUT): a current review of cell signaling processes in ureteral development. J Pediatr Urol 2006; 2: 2-9. ↩ ↩2 ↩3
-
Woolf AS. A molecular and genetic view of human renal and urinary tract malformations. Kidney Int 2000; 58: 500-512. ↩ ↩2 ↩3
-
Takahashi M. The GDNF/RET signaling pathway and human diseases. Cytokine Growth Factor Rev 2001; 12: 361-373. ↩ ↩2 ↩3
-
Batourina E, Choi C, Paragas N et al. Distal ureter morphogenesis depends on epithelial cell remodeling mediated by vitamin A and Ret. Nat Genet 2002; 32: 109-115. ↩ ↩2 ↩3 ↩4
-
Batourina E, Tsai S, Lambert S et al. Apoptosis induced by vitamin A signaling is crucial for connecting the ureters to the bladder. Nat Genet 2005; 37: 1082-1089. ↩ ↩2 ↩3 ↩4 ↩5
-
Tanagho EA, Smith DR, Meyers FH. The trigone: anatomical and physiological considerations. 2. In relation to the bladder neck. J Urol 1968; 100: 633-639. ↩ ↩2 ↩3
-
Tanagho EA, Meyers FH, Smith DR. The trigone: anatomical and physiological considerations. I. In relation to the ureterovesical junction. J Urol 1968; 100: 623-632. ↩ ↩2 ↩3
-
Viana R, Batourina E, Huang H et al. The development of the bladder trigone, the center of the anti-reflux mechanism. Development 2007; 134: 3763-3769. ↩ ↩2 ↩3
-
Pirker ME, Rolle U, Shinkai T, Shinkai M, Puri P. Prenatal and postnatal neuromuscular development of the ureterovesical junction. J Urol 2007; 177: 1546-1551. ↩ ↩2 ↩3
-
Matsuno T, Tokunaka S, Koyanagi T. Muscular development in the urinary tract. J Urol 1984; 132: 148-152. ↩ ↩2 ↩3
-
Tanagho EA. Intrauterine fetal ureteral obstruction. J Urol 1973; 109: 196-203. ↩ ↩2 ↩3
-
Dixon JS, Jen PY, Yeung CK et al. The structure and autonomic innervation of the vesico-ureteric junction in cases of primary ureteric reflux. Br J Urol 1998; 81: 146-151. ↩ ↩2 ↩3
-
Lee BR, Silver RI, Partin AW, Epstein JI, Gearhart JP. A quantitative histologic analysis of collagen subtypes: the primary obstructed and refluxing megaureter of childhood. Urology 1998; 51: 820-823. ↩ ↩2 ↩3
-
Hertle L, Nawrath H. In vitro studies on human primary obstructed megaureters. J Urol 1985; 133: 884-887. ↩ ↩2 ↩3
-
Payabvash S, Kajbafzadeh AM, Tavangar SM, Monajemzadeh M, Sadeghi Z. Myocyte apoptosis in primary obstructive megaureters: the role of decreased vascular and neural supply. J Urol 2007; 178: 259-264. ↩ ↩2 ↩3
-
Kang HJ, Lee HY, Jin MH, Jeong HJ, Han SW. Decreased interstitial cells of Cajal-like cells, possible cause of congenital refluxing megaureters: Histopathologic differences in refluxing and obstructive megaureters. Urology 2009; 74: 318-323. ↩ ↩2 ↩3
-
Garne E, Loane M, Wellesley D, Barisic I. Congenital hydronephrosis: prenatal diagnosis and epidemiology in Europe. J Pediatr Urol 2009; 5: 47-52. ↩ ↩2 ↩3
-
Gordon I, Colarinha P, Fettich J, Fischer S, Frokier J. Guidelines for Standard and Diuretic Renogram in Children. 2000. European Association of Nuclear Medicine Guidelines. ↩ ↩2 ↩3
-
Gordon I. Diuretic renography in infants with prenatal unilateral hydronephrosis: an explanation for the controversy about poor drainage. BJU Int 2001; 87: 551-555. ↩ ↩2 ↩3 ↩4 ↩5
-
McLellan DL, Retik AB, Bauer SB et al. Rate and predictors of spontaneous resolution of prenatally diagnosed primary nonrefluxing megaureter. J Urol 2002; 168: 2177-2180. ↩ ↩2 ↩3
-
Cay A, Imamoglu M, Bahat E, Sarihan H. Diagnostic difficulties in children with coexisting pelvi-ureteric and vesico-ureteric junction obstruction. BJU Int 2006; 98: 177-182. ↩
-
Peters CA, Mandell J, Lebowitz RL et al. Congenital obstructed megaureters in early infancy: diagnosis and treatment. J Urol 1989; 142(2 Pt 2):641-645. ↩
-
Keating MA, Escala J, Snyder HM, III, Heyman S, Duckett JW. Changing concepts in management of primary obstructive megaureter. J Urol 1989; 142(2 Pt 2):636-640. ↩
-
Baskin LS, Zderic SA, Snyder HM, Duckett JW. Primary dilated megaureter: long-term followup. J Urol 1994; 152(2 Pt 2):618-621. ↩ ↩2
-
Shukla AR, Cooper J, Patel RP et al. Prenatally detected primary megaureter: a role for extended followup. J Urol 2005; 173: 1353-1356. ↩
-
Hemal AK, Ansari MS, Doddamani D, Gupta NP. Symptomatic and complicated adult and adolescent primary obstructive megaureter–indications for surgery: analysis, outcome, and follow-up. Urology 2003; 61: 703-707. ↩
-
Peters CA, Mandell J, Lebowitz RL et al. Congenital obstructed megaureters in early infancy: diagnosis and treatment. J Urol 1989; 142(2 Pt 2):641-645. ↩
-
Paquin AJ, Jr. Ureterovesical anastomosis: the description and evaluation of a technique. J Urol 1959; 82: 573-583. ↩
-
Starr A. Ureteral plication. A new concept in ureteral tailoring for megaureter. Invest Urol 1979; 17: 153-158. ↩
-
Kalicinski ZH, Kansy J, Kotarbinska B, Joszt W. Surgery of megaureters–modification of Hendren's operation. J Pediatr Surg 1977; 12: 183-188. ↩ ↩2
-
Hendren WH. Operative repair of megaureter in children. J Urol 1969; 101: 491-507. ↩ ↩2
-
Ben-Meir D, McMullin N, Kimber C, Gibikote S, Kongola K, Hutson JM. Reimplantation of obstructive megaureters with and without tailoring. J Pediatr Urol 2006; 2: 178-181. ↩
-
DeFoor W, Minevich E, Reddy P et al. Results of tapered ureteral reimplantation for primary megaureter: extravesical versus intravesical approach. J Urol 2004; 172(4 Pt 2):1640-1643. ↩
-
Ansari MS, Mandhani A, Khurana N, Kumar A. Laparoscopic ureteral reimplantation with extracorporeal tailoring for megaureter: a simple technical nuance. J Urol 2006; 176(6 Pt 1):2640-2642. ↩
-
Hemal AK, Nayyar R, Rao R. Robotic repair of primary symptomatic obstructive megaureter with intracorporeal or extracorporeal ureteric tapering and ureteroneocystostomy. J Endourol 2009; 23: 2041-2046. ↩
-
de Jong TP. Treatment of the neonatal and infant megaureter in reflux, obstruction and complex congenital anomalies. Acta Urol Belg 1997; 65: 45-47. ↩
-
de Kort LM, Klijn AJ, Uiterwaal CS, De Jong TP. Ureteral reimplantation in infants and children: effect on bladder function. J Urol 2002; 167: 285-287. ↩
-
Shenoy MU, Rance CH. Is there a place for the insertion of a JJ stent as a temporizing procedure for symptomatic partial congenital vesico-ureteric junction obstruction in infancy? BJU Int 1999; 84: 524-525. ↩
-
Farrugia MK, Steinbrecher HA, Malone PS. The utilization of stents in the management of primary obstructive megaureters requiring intervention before 1 year of age. J Pediatr Urol 2010. ↩ ↩2 ↩3
-
Angerri O, Caffaratti J, Garat JM, Villavicencio H. Primary obstructive megaureter: initial experience with endoscopic dilatation. J Endourol 2007; 21: 999-1004. ↩
-
Kajbafzadeh AM, Payabvash S, Salmasi AH et al. Endoureterotomy for treatment of primary obstructive megaureter in children. J Endourol 2007; 21: 743-749. ↩
-
Lee SD, Akbal C, Kaefer M. Refluxing ureteral reimplant as temporary treatment of obstructive megaureter in neonate and infant. J Urol 2005; 173: 1357-1360. ↩
-
Gearhart JP. Primary obstructive ureter in neonates. Treatment by temporary uretero-cutaneostomy. Br J Urol 1994; 74: 133-134. ↩









