Dermatosis genitourinarias pediátricas: una revisión exhaustiva
Riel Smith-Harrison, Zaineb Makhzoumi, Jules Manger, Sean T. Corbett
Universidad de Virginia, Charlottesville, VA, USA
Traducido y editado desde el original al español | Enlace a la versión en inglés
Dra Maria Santos, Dra Carolina Acuña
Hospital Padre Hurtado, Santiago Chile
Introducción
Las dermatosis genital en la población pediátrica requiere de consideración especial ya que la piel de los genitales en niños es diferente a la de los adultos. En los niños, la ausencia de hormonas sexuales produce una piel delgada, sin protección de glándulas ni vello. Los bebés y los niños pueden ser incontinentes, lo que hace que la irritación química y la humedad crónica de las heces y la orina causen o exacerben la dermatosis.
Frecuentemente son condiciones congénitas de la piel como también neoplasias benignas sugerentes de alguna condición genética. Por el contrario, las afecciones genitourinarias dermatológicas malignas e infecciosas son relativamente raras en niños en comparación con los adultos. Esto debido a que los niños generalmente no están expuestos a infecciones de transmisión sexual ni a inflamación crónica y tienen un mejor sistema inmune.
La atopia está en su punto máximo en la infancia y tiende a disminuir en la edad adulta. Así, la dermatitis atópica y otros trastornos mediados por alergia de la piel genital tienden a ser más comunes en los niños.
El tratamiento de las dermatosis genitales en niños es un reto debido a la preocupación por los efectos secundarios sistémicos de los esteroides, inmunomoduladores y antifúngicos. El manejo expectante de ciertas afecciones puede ser apropiado ya que muchas lesiones dermatológicas son benignas y autolimitadas; sin embargo, el tratamiento quirúrgico tiene la ventaja de obtener un diagnóstico histopatológico, mejorar la función o la cosmética de los genitales o, menos frecuentemente, curar la lesión.
Finalmente, las condiciones dermatológicas genitourinarias pediátricas pueden hacer sospechar abuso sexual, ya sea legítimo o no. Los cuidadores pueden ser esconder o evitar entregar información relacionada a la evolución de las lesiones genitales en niños. Es por esto que el examen genital en los niños suele ser un tema delicado y obviamente se agrava en el contexto de abuso.
Dermatitis alérgica
La dermatitis alérgica se caracteriza por lesiones eritematosas pruriginosas asociadas con una exposición en particular. Estos eventos son bastante comunes y a menudo se asocian con el sistema genitourinario.
Dermatitis atópica
La dermatitis atópica (DA), o eccema, es una afección crónica de la piel caracterizada por piel seca y pruriginosa con placas eccematosas liquenificadas. Aproximadamente un 20% de la población pediátrica presenta DA y al menos el 85% de los individuos afectados muestran síntomas antes de los 5 años.1 La genética juega un papel importante en la DA, con más de 20 genes involucrados. La dermatitis atópica también se asocia con sustancias y condiciones particulares que pueden empeorar los síntomas. Estos incluyen; calor, lana, transpiración, estrés emocional, aeroalergenos (ácaros del polvo, polen) y alérgenos alimentarios.2 Cualquiera de estos factores gatillantes puede generar una dermatitis generalizada en genitales.
Dermatitis de contacto
Se pensaba que la dermatitis de contacto (DC) era poco común en la población pediátrica, pero es cada vez más frecuente en los niños. La DC se divide con mayor frecuencia en: dermatitis de contacto irritante (DCI) y dermatitis de contacto alérgica (DCA). La presentación de estas dos formas es a menudo similar con áreas afectadas limitadas a áreas de contacto. Sin embargo, existen diferencias sutiles en que la DCA generalmente se presenta con placas eccematosas exudativas y la DCI como quemaduras agudas. El tratamiento consiste en identificar el desencadenante, eliminar su exposición y tratar la fase inflamatoria aguda.
La DCA implica una reacción de hipersensibilidad de tipo IV, en la que hay una reacción a un alérgeno que produce una fase inicial de sensibilización. Los sensibilizadores más comunes son: níquel, fragancias, hule, lanolina y antibiótico.3,4 La DCA se ve con más frecuencia como una lesión pruriginosa, que puede convertirse en ampollas y lesiones exudativas. Los ejemplos de compromiso genital incluyen reacciones al aceite de canela en supositorios vaginales y dermatitis vulvar al clotrimazol.5,6 La DCA también se ha asociado con el níquel que se encuentra en algunas alarmas para el manejo de enuresis.7 La eliminación del agente gatillante detendrá el proceso de erupción e irritación.
La DCI es causada por los efectos citotóxicos directos del agente ofensor. La severidad de la reacción se puede alterar por la duración del contacto, los factores ambientales y la dermatitis concurrente. El DCI más común es la dermatitis del pañal (DP). Varios factores contribuyen al desarrollo de la DP, como la fricción, la orina, las heces y la maceración de la piel por el agua. El cuidado inadecuado de la piel y Candida albicans también han demostrado aumentar las tasas de DP.8,9 Las áreas más susceptibles a la DP son las zonas perianales, glúteos e intertriginosas. El área genital es mucho más probable que se vea afectada en las mujeres.10 Períodos más cortos en contacto con orina y heces, pañales absorbentes y una buena higiene son importantes para prevenir la DP. Otras terapias incluyen la Nistatina, Hidrocortisona y pastas protectoras. Todos estos vienen con efectos secundarios potenciales y pueden causar dermatosis genitourinarias primarias.11
Eritema multiforme (síndrome de Stevens-Johnson)
El eritema multiforme (EM) es una afección dermatológica generalizada, caracterizada por la aparición aguda y autolimitada de lesiones que afectan la piel y las mucosas. La EM se clasifica en EM menor, mayor y el síndrome de Stevens-Johnson (SJS) según la gravedad. Tradicionalmente, la EM se describe como lesiones diana y pápulas rojas simétricas. En su forma más grave, las lesiones se asemejan a quemaduras cutáneas extensas con pápulas eritematosas y ampollas.12 Las lesiones de esta gravedad requieren cuidados intensivos y se asocian con una significativa morbilidad y mortalidad. La EM tiene una predilección por atacar las mucosas, incluidos, entre otros, los genitales y la mucosa oral.
Mesa 1. Causas de eritema multiforme
| Drogas | Agentes infecciosos |
|---|---|
| Antiinflamatorios no esteroidales | VEB |
| Anticonvulsivantes | VHS |
| Antimicóticos | CMV |
| Neumonía por mycoplasma | |
| Antibióticos | Hepatitis |
| 1. sulfonamidas | Virus de varicela zoster |
| 2. penicilinas | Infecciones por hongos |
| 3. cefalosporinas | Parásitos |
| 4. quinolonas | Estreptococos |
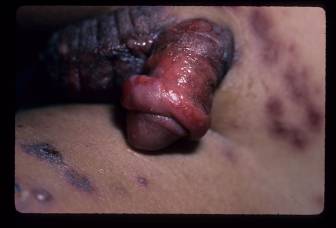
Figura 1
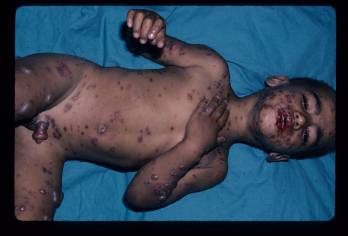
Figura 2
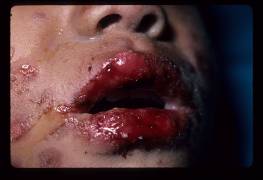
Figura 3
Figuras 1-3. Niño pequeño con síndrome de Stevens-Johnson. Nótese la afección focal de la mucosa oral con erosiones generalizadas, que también afectan al pene.
En los niños, la EM se asocia frecuentemente con el VHS, Mycoplasma pneumoniae, sulfonamidas y ß-lactamasas.13,14 El EM puede precipitarse tanto por VHS-1 como por VHS-2. Es producido entre 10 y 14 días después de la infección y, a veces, se manifiestan síntomas prodrómicos. El pródromo no es tan grave como el observado con SJS, puede incluir fiebre, dolor de cabeza y tos. El tratamiento es de soporte y se puede indicar Aciclovir para los episodios recurrentes.14 La neumonía por Mycoplasma está particularmente asociada con el desarrollo de SJS. Por lo general, está precedida por una fase prodrómica de fiebre, dolor de cabeza, síntomas respiratorios altos y / o odinofagia. Cuando los genitales están involucrados, la presentación más común son erosiones con eritema y posible sangrado del glande y de los labios.15 Dichas lesiones pueden llevar a complicaciones como se observó en una niña de 14 años que desarrolló hematocolpos luego de una infección por M. neumonía asociada a SJS con lesiones flictenares en los genitales externos e internos.16 El tratamiento generalmente se limita a medidas de apoyo. Si la etiologia es M. neumonía, se justifica el uso de antibióticos.
Picaduras de insectos
El tronco y las extremidades suelen ser los sitios más comunes de picaduras de insectos, aún así los genitales no son un sitio infrecuente. Son muchos los insectos causantes como; mosquitos, garrapatas, avispas, ácaros, hormigas, niguas y abejas. La mayoría de las picaduras ocurren durante los meses más cálidos, cuando los niños están afuera y expuestos a insectos. Si bien los síntomas más comunes son prurito, eritema e inflamación local, algunas reacciones pueden ser sistémicas y las picaduras particularmente venenosas pueden conducir a síntomas más preocupantes. Las reacciones de hipersensibilidad resultantes varían en intensidad desde un ligero eritema hasta la erupción de pápulas y vesículas. En algunos casos, la ubicación y la forma particular de reacción pueden hacer sospechar el tipo de insecto. El eritema migrans típicamente indica una picadura de garrapata, mientras que las erupciones genitales acompañadas de mordeduras en las líneas de ropa sugieren niguas.17,18 Si los genitales se han expuesto al aire libre y las picaduras se asocian con eritema, ronchas y angioedema, los mosquitos pueden ser los causantes.19
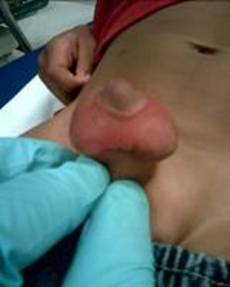
Figura 4. Picadura de garrapata e hinchazón asociada del escroto en un niño pequeño.
El tratamiento de estas picaduras es principalmente sintomático con el uso de esteroides tópicos y antihistamínicos. El uso de ropa de manga larga y repelentes son útiles para prevenir las picaduras de insectos. También es importante que los pacientes reconsulten si aparecen nuevos síntomas, persisten o si progresan las lesiones,19 debido a que esto podría indicar una sobreinfección bacteriana. La fiebre, el malestar y las artralgias podrían indicar la transmisión de una enfermedad transmitida por vectores, como la enfermedad de Lyme o la fiebre manchada de las Montañas Rocosas.18 El tratamiento con antibióticos entonces se vuelve necesario.
Trastornos papuloescamosos
Liquen escleroso (Balanitis xerotica obliterans)
El liquen escleroso es un proceso inflamatorio crónica que afecta principalmente la región perineal de hombres y mujeres. Las lesiones características son áreas de palidez, adelgazadas, frágiles y atróficas. La piel suele estar arrugada y pueden observarse telangiectasias, púrpura, fisuras o erosiones. La progresión de la enfermedad puede provocar cicatrización, fimosis en los hombres y degeneración en carcinoma de células escamosas.20 Cuando este proceso se encuentra en los hombres y se limita al pene, se conoce como balanitis xerótica obliterante (BXO). Es histológicamente idéntico al liquen escleroso y se trata igual.21 Esta también se puede asociar con liquen plano y el penfigoide cicatricial.22 Tanto el liquen escleroso como la BXO son procesos atróficos y escleróticos con una fisiopatología poco clara. El trabajo que involucra una teoría autoinmune, ha demostrado una mayor incidencia de HLA DQ7 en pacientes pediátricos, esta asociación es incluso mayor que la observada en adultos.23
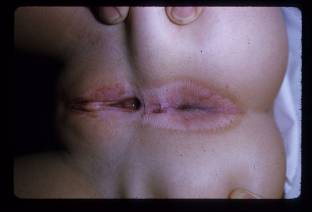
Figura 5. Liquen escleroso. Tenga en cuenta la apariencia de "reloj de arena" en la vulva y el ano, con centro blanco atrófico y eritema e hiperpigmentación circundantes.
La evolución de la enfermedad observada en niños con liquen escleroso es ligeramente diferente al de los adultos. La edad media de la primera presentación es de 5 años y la edad media de diagnóstico de 7 años. En las niñas, los síntomas más comunes son prurito y dolor. Otros síntomas incluyen erosiones genitales, fisuras, disuria, púrpura y estreñimiento. Un pequeño porcentaje de niñas no tiene síntomas. En los niños, el liquen escleroso está asociado con la fimosis, tanto congénita como adquirida. La cicatrización del meato uretral también puede provocar estenosis e incluso fibrosis uretral.24 El diagnóstico se realiza con mayor frecuencia sobre una base clínica, pero la biopsia de las lesiones mostrará infiltrado inflamatorio y degeneración dermoepidérmica.21 El tratamiento del liquen escleroso es de suma importancia debido a la posibilidad de transformación en un proceso maligno. El tratamiento inicial para el liquen escleroso involucra potentes esteroides tópicos que incluyen betametasona y clobetasol.25 Más recientemente, se han utilizado inmunomoduladores como pimecromilus y tacrolimus con buenos resultados, siendo este ultimo utilizado también como adyuvante posterior a la cirugía.26,27 La cirugía puede ser necesaria para las lesiones que conducen a la fimosis, la estenosis meatal o la estenosis uretral. El liquen escleroso es una enfermedad recurrente, sin embargo, en algunos casos pediátricos, el liquen escleroso se resuelve completamente. Se discute la frecuencia de resolución, pero se piensa que el liquen escleroso pediátrico tiene un mejor pronóstico que la forma adulta. El papel de la pubertad en este proceso está aún bajo debate.28
Psoriasis
La psoriasis es un trastorno de la piel mediado por el sistema inmunitario que genera lesiones inflamatorias e hiperproliferativas características. Es un trastorno bastante común, con una prevalencia de alrededor del 2% en la población general. Tradicionalmente, estas lesiones se caracterizan como lesiones similares a placas en el cuero cabelludo y en las superficies extensoras del cuerpo. La psoriasis puede presentarse en cualquier lugar y la afectación genital no es infrecuente. Las lesiones genitales a menudo se presentan como lesiones eritematosas, bien demarcadas y con placas delgadas que carecen de la descamación tradicional. Si se presenta descamación, es mínima y se raspa con facilidad, esto producirá un sangrado puntiforme. En un estudio, la edad media de presentación con compromiso genital fue de 35 años, aunque puede presentarse a cualquier edad.29
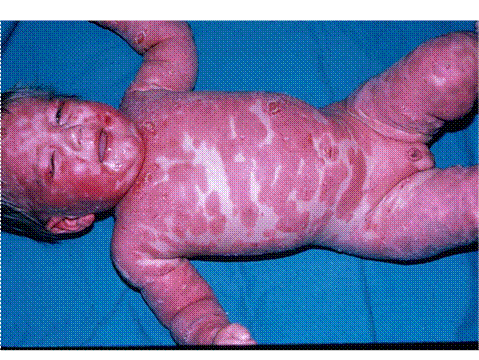
Figura 6. Presentación eritrodérmica de la psoriasis, con eritema casi confluente con descamación.
Frente a la presentación de lesiones con eritema, descamación o prurito en la región perineal, la psoriasis debe ser parte del diagnóstico diferencial. En la población pediátrica la psoriasis se asocia con vulvovaginitis crónica.30 El diagnóstico generalmente se realiza después de observar la evolución en el tiempo, la historia familiar y una adecuada historia y examen físico en busca de otras lesiones de la piel.31,32 La presentación clínica y la historia suelen ser suficientes para el diagnóstico. Si el diagnóstico no es seguro, se puede tomar una biopsia para obtener el diagnostico definitivo. Otra opción menos invasiva es el uso de la videodermatoscopia. En el examen de la balanitis psoriática con videodermatoscopia, en todos los pacientes se observan capilares dilatados y tortuosos.33 Si la afectación psoriática se limita a los genitales, el tratamiento sistémico es innecesario. Junto con la higiene y la eliminación de factores irritantes, el tratamiento tiende a centrarse en los esteroides tópicos, como la betametasona o la crema de licor picis carbonis (LPC).31,32 Si esto no tiene éxito, los ensayos recientes de inmunomoduladores como pimecromilus han tenido éxito.34
Síndrome de Reiter
El síndrome de Reiter, también conocido como artritis reactiva, es una espondiloartropatía seronegativa caracterizada por artritis, conjuntivitis y uretritis. Tradicionalmente, se sabe que este proceso patológico se presenta después de episodios de infecciones gastrointestinales y urogenitales en varones jóvenes. En general, el síndrome de Reiter es más común en adultos que en niños y en hombres que en mujeres. Si bien no se conoce la fisiopatología exacta, se cree que la infección causante puede causar una reacción cruzada con los organismos o liberación de citoquinas.35
En los niños, los hallazgos más comunes son conjuntivitis bilateral, disuria y artritis asimétrica. La gravedad de los síntomas puede variar y deben estar todos presentes. Se puede acompañar también con fiebre, malestar general y pérdida de peso. La manifestación mucocutánea más común de los genitales es la balanitis circinada o vulvitis. En los niños, estas lesiones se describen como úlceras con bordes superficiales y serpiginosos en niños no circuncidados. En varones circuncidados, se describen placas hiperqueratósicas. Los estudios describen que, estas lesiones se encuentran en el 50% de los pacientes, y la presencia de la balanitis y la vulvitis deberían llevar a considerar el síndrome de Reiter juvenil.36,37 El diagnóstico se realiza en base al examen físico e historia. Los valores de laboratorio anormales pueden incluir leucocitosis, VHS y PCR elevada. Si bien estos son hallazgos inespecíficos, se ha demostrado que los niveles de VHS y PCR observados en el síndrome de Reiter no son tan elevados como los observados en la artritis idiopática juvenil.38 El tratamiento del síndrome de Reiter consiste en AINES y, si es lo suficientemente grave, inmunomoduladores. Las manifestaciones cutáneas tratadas con esteroides tópicos y ácido salicílico han tenido buenos resultados.36
Erupciones de drogas fijas
Las erupciones de drogas fijas (FDE, por sus siglas en inglés) se caracterizan por lesiones redondeadas y bien delimitadas que varían de 2 a 10 cm de diámetro. Pueden ser eritematosos a violáceos y su aparición está asociada con la ingestión de un medicamento en particular. El tiempo en desarrollar las lesiones puede variar de horas hasta días y las lesiones se resolverán en una semana. Una vez que las placas se hayan resuelto, la hiperpigmentación permanecerá y puede durar de meses a años. Estas reacciones pueden manifestarse en cualquier parte del cuerpo, pero tienden a afectar el tronco, las membranas mucosas y los genitales. Las claves para el diagnóstico clínico son las lesiones características, la exposición reciente a medicamentos y la recurrencia en el mismo lugar con exposición repetida.39
Las erupciones de drogas fijas son una lesión cutánea dermatológica común en los niños. La afectación genital se ha reportado en un 20% a 50% de los casos. La presentación clínica generalmente consiste en las lesiones características que se desarrollan en la vulva, el glande y, ocasionalmente, el pene o escroto. Los niños también se pueden presentar con prurito, micción dolorosa y retención urinaria.40 La lista de medicamentos que pueden causar estas reacciones es larga, pero hay algunos más frecuentes como; aspirina, paracetamol, colchicina, fenobarbitol, lidocaína y metilfenidato. Antibióticos como el cotrimoxazol, la tetraciclina, el metronidazol y la eritromicina también se han reportado como causas. El cotrimoxazol y la tetraciclina han sido seleccionados en particular por su afectación genital.41,40 Si bien los síntomas pueden ser molestos y dejar atrás una hiperpigmentación reveladora, la intervención no es necesaria ya que este es un proceso benigno. Es prudente sin embargo, identificar el causante para así evitar una exposición posterior.
Trastornos vesiculobulosos
Esta patología dermatológica se compone de trastornos que implican la detección de autoanticuerpos en la piel y mucosas. Los autoanticuerpos atacan las diversas estructuras (desmosomas, hemidesmosomas) que crean integridad estructural de la piel y mucosas. La incidencia de estos trastornos es baja y puede conducir a una formación extensa de ampollas. Cuando se trata de regiones genitales o perianales, es importante descartar abuso infantil.42
Penfigoide bulloso
El penfigoide bulloso (PB) es un proceso crónico, autoinmune, caracterizado por el desarrollo de ampolla tensas en piel normal o inflamada. Su incidencia en los niños es baja y la participación de los genitales aún más. Las lesiones se encuentran generalmente en zonas flexoras y mucosa oral. El desarrollo de manifestaciones cutáneas implica autoanticuerpos IgG dirigidos a la zona de la membrana basal de la piel (BMZ) y la posterior formación de ampollas. La confirmación diagnóstica requiere de biopsia con inmunofluorescencia directa y en algunos casos el aislamiento de antígenos diana puede ser útil.43
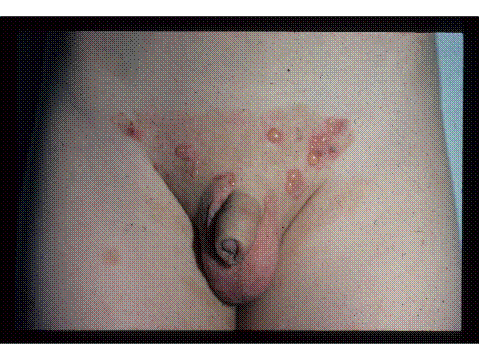
Figura 7. Penfigoide ampollar en un niño con múltiples ampollas tensas con eritema circundante.
Si bien el compromiso de genitales en niños es rara, se han observado múltiples casos tanto en niños como en niñas. Cuando se trata de niños, las características de la enfermedad incluyen inflamación crónica y ampollas en el glande y fimosis severa.44 En mujeres jóvenes, el PB se caracteriza por molestias, disuria y ampollas subepidérmicas de la vulva. Nuevamente, la inmunofluorescencia ha demostrado la deposición lineal de IgG en la unión dermoepidérmica y los antígenos BP230 y BP180. La mayoría de estos pacientes epidermizan bien sin dejar cicatrices ni cambios en la vulva.45 Los pacientes que tienen compromiso sistémico más generalizado tienden a tener resultados menos satisfactorios y pueden requerir terapias más agresivas.
El tratamiento de la PB generalmente es exitoso, con múltiples opciones disponibles. Los corticosteroides orales son la terapia de primera línea, la adición de dapsona y sulfapiridina también ha mostrado beneficios en algunos casos.44 Las preparaciones tópicas como la crema de propionato de clobetasol, la oxitetraciclina y la nistatina también han demostrado ser eficaces.45 Cuando estas medidas no tienen éxito, se pueden probar los corticosteroides más potentes y la terapia de pulso. Si estas medidas aún no tienen éxito, se ha demostrado que el uso de Ig EV junto con esteroides produce un resultado terapéutico.46
Pénfigo vulgar
El pénfigo vulgar (PV) representa un grupo de enfermedades dérmicas raras caracterizadas por la formación de ampollas autoinmunes en piel y mucosas. En pacientes con pénfigo, los autoanticuerpos dirigidos contra las proteínas desmosomales conducen a la escisión intraepidérmica y la formación de ampollas en la dermis profunda. La inmunofluorescencia de las muestras de biopsia sugiere un proceso mediado predominantemente por IgG acompañado de depósitos de C3.47 El desarrollo de pénfigo en los niños es raro, y la mayoría de los casos se presentan entre la cuarta y la sexta década de vida.
Al igual que en la enfermedad del adulto, el pénfigo infantil produce ampollas recurrentes de piel y mucosas y la separación suprabasal de la piel. Con la progresión de la enfermedad, las superficies ampolladas eventualmente se rompen, dejando la piel desnuda y cruda. El signo de Nikolsky es muchas veces positivo. La afectación genital es rara, pero consiste en ampollas en la mucosa vaginal.48 Como la mayoría de los procesos autoinmunes, la terapia con esteroides juega un papel central en el cuidado de estos pacientes. Los corticosteroides orales forman la base de la terapia con la adición de dapsona, micofenolato de mofetilo, azotiopina y ciclofosfamida en casos refractarios.49 Últimamente se ha sugerido el uso de rituximab con IgEV, un anticuerpo monoclonal antiCD20, en casos refractarios.
Epidermólisis Bullosa
La epidermólisis bullosa (EB) es una afección dermatológica congénita rara, caracterizada por una piel frágil y frecuentes ampollas y degradación de las membranas mucosas y la dermis. Esta condición se divide en tres categorías: EB simple, EB de la unión y EB distrófica. La distinción está determinada por la participación específica de un gen y la zona de la membrana basal afectada. El diagnóstico inicial generalmente se hace a partir de manifestaciones clínicas y antecedentes familiares. El diagnóstico definitivo se puede realizar mediante biopsia y microscopía de inmunofluorescencia directa.50 La participación del tracto genitourinario es un componente importante. Cualquier paciente con EB de unión o distrófica sumado a hematuria o estenosis pilórica debe ser evaluado en búsqueda de compromiso genitourinario.
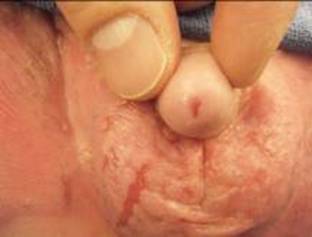
Figura 8. Desarrollo de estenosis meatal en un niño con epidermólisis bullosa.
Las complicaciones genitourinarias de la EB se observan con mayor frecuencia en las formas de unión y distróficas. Los hallazgos dermatológicos de los genitales pueden incluir estenosis meatal, ulceración del glande y labios, cicatrización del glande, fusión de los labios y estrechamiento del vestíbulo vaginal. Junto con el compromiso de genitales externos, el tracto genitourinario también puede verse afectado por estenosis y complicaciones relacionada.51,52 Junto con el dolor y la incomodidad asociados con la formación de ampollas, pueden también presentar disuria e infecciones recurrentes. El objetivo principal del urólogo debe ser la preservación de la función renal debido a la tendencia al desarrollo de estenosis y disfunción de la vejiga. El principal tratamiento es la desviación urinaria, la forma particular de desviación depende de la participación del tracto gastrointestinal y el pronóstico del paciente.53
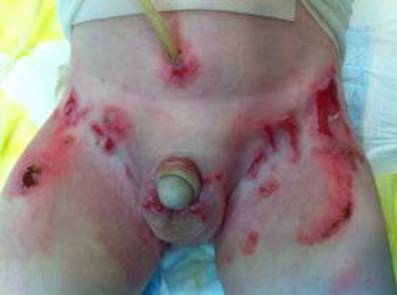
Figura 9. Compromiso genital e inguinal en un niño con Epidermólisis bullosa. Obliteración completa del meato y la uretra distal que requiere la colocación de un cystofix observe la reacción alrededor del tubo.
Úlceras no infecciosas
Pioderma gangrenoso
El pioderma gangrenoso (PG) es un proceso inmune mediado por el desarrollo de una enfermedad cutánea ulcerativa. Estas úlceras, que pueden variar en tamaño, profundidad y ubicación, suelen ir precedidas de pústulas. El PG se ha asociado tradicionalmente con otras condiciones sistémicas. Estas incluyen, entre otros, la enfermedad inflamatoria intestinal (EII) y los trastornos mieloproliferativos, como la gammapatía monoclonal y el mieloma. Histológicamente, este proceso patológico está asociado con un infiltrado inflamatorio que involucra neutrófilos, macrófagos y linfocitos T. Se ha demostrado que estas células producen una serie de citoquinas inflamatorias, en particular TNF-α, que contribuyen a la patología.54 El diagnóstico es difícil, aunque las manifestaciones clínicas particulares pueden sugerir PG.55 Los casos de PG en niños solo representan el 4% de todos los casos, y el compromiso de los genitales es solo una parte de este subconjunto. Si bien es extremadamente raro, se ha informado del compromiso tanto de la vulva como del pene. La afectación del pene se ha demostrado con ulceración del glande, frenillo y cuerpo del pene. La evolución de la PG en estos casos también puede llevar a complicaciones como fístulas uretrales.56 El tratamiento de la PG en estos casos se centra en la modulación inmune, siendo el tratamiento de primera línea con corticosteroides y ciclosporina. Para casos más refractarios, antagonistas de TNF-α como el infliximab y otros inmunosupresores como el tacrolimus han sido recomendados.54
Enfermedad de Behçet
La enfermedad de Behçet es una enfermedad inflamatoria multisistémica de causa desconocida. Esta rara enfermedad se caracteriza por ulceras orales recurrentes acompañadas de ulceración genital, lesiones oculares (uveítis anterior, uveítis posterior y vasculitis retiniana) y lesiones cutáneas (eritema nodoso, nódulos acneiformes y pseudofoliculitis). Se cree que la incidencia y la forma de presentación varía entre las poblaciones. Un estudio en América del Norte informó una incidencia de 0,38 por cada 100.000 personas.57
La enfermedad de Behçet tiende a desarrollarse en la tercera y cuarta décadas de la vida. Si bien algunos casos se informan tan pronto como el primer año de vida, la edad media de presentación es de aproximadamente 15 años. Se han reportado lesiones genitales en hasta el 70% de los pacientes pediátricos con predominio en vulva, escroto y pene. También se han visto casos de compromiso perianal.58,59 El diagnóstico se basa en criterios clínicos y estándares internacionales, aunque una prueba de patología cutánea positiva puede ser confirmatoria. Se han probado múltiples terapias farmacológicas con la enfermedad de Behçet, aunque han habido pocos estudios que analizan específicamente el tratamiento de las manifestaciones genitales en niños. Las preparaciones tópicas como la triamcinilona se pueden usar para casos leves. Si la enfermedad mucocutánea es grave, se pueden probar terapias sistémicas como la colchicina, la ciclofosfamida y la azotioprina.60 En un caso particular, la talidomida tuvo éxito en el control de la ulceración genital.59
Infecciones
Gangrena De Fournier
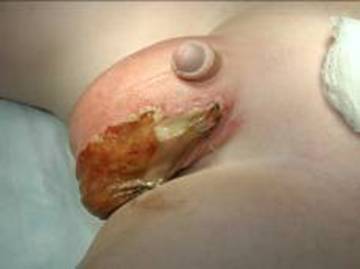
Figura 10. Gangrena de Fournier en escroto de paciente pediátrico.
La gangrena de Fournier (GF) es el desarrollo agudo de la fascitis necrotizante del escroto, periné o área perianal y se asocia con alta morbimortalidad. Los factores de riesgo comunes incluyen diabetes mellitus, vejez, malignidad y estados inmunocomprometidos. La fuente inicial de infección tiende a provenir de la enfermedad colorrectal, la enfermedad urológica y el trauma.61 Generalmente la infección es polimicrobiana con mayor frecuencia por Escherichia coli , Staphylococcus aureus y Klebsiella pneumoniae. Los síntomas más comunes son fiebre, dolor, aumento de volumen, secreción purulenta y cambios eritematosos en la piel.62 También se puede observar la enfisema cutáneo y el dolor desproporcionado. La GF es una emergencia quirúrgica debido a la rápida progresión de la infección a la pared y cavidad abdominal. Esto puede conducir rápidamente a sepsis y muerte. Por este motivo, se debe descartar la GF en cualquier caso de infección de tejidos blandos que afecte a los genitales o regiones perianales.
La GF es una entidad rara en la población pediátrica, aunque hay casos descritos en neonatos. En los niños, la presentación y el tratamiento es bastante similar al de los adultos. A diferencia de los adultos se agrega a la etiologia la circuncisión, las picaduras de insectos y la higiene inadecuada.63 También se ha asociado con infección por varicela.64. Independientemente de la etiología, la GF sigue siendo una emergencia quirúrgica y requiere una acción rápida.
El manejo se basa en un diagnóstico oportuno, el inicio de antibióticos de amplio espectro y el desbridamiento quirúrgico. El cuidado adecuado de las heridas también es fundamental en estos pacientes con cambios frecuentes de apósito y atención para mantener limpia el área afectada. Esto puede requerir de desviación urinaria o fecal para prevenir mayor infección.63 Una vez que el paciente se ha estabilizado, se puede dirigir la atención hacia medidas reconstructivas utilizando injertos de piel y varios colgajos. Las mejoras en la calidad de vida se asocian con la cobertura temprana de heridas y la cirugía reconstructiva.62 A pesar del tratamiento agresivo, la mortalidad en pacientes con GF puede ser tan alta como 30-40%.
Molusco contagioso
El molusco contagioso (MC) es causado por un conjunto de virus de la familia Poxviridae. Estos virus, MCVs-1, 2 y 3, causan lesiones solevantas y umbilicadas de la epidermis. Suelen observarse como pápulas umbilicadas de color carne, siendo generalmente múltiples. Las lesiones causadas por el MCV son en su mayoría autolimitadas, pero pueden durar desde 6 meses hasta 5 años. Debido a que la mayoría de las infecciones se contagian por contacto sexual, se considera una enfermedad de transmisión sexual.65 En la población pediátrica, dos tercios de los casos se encuentran en niños menores de ocho años y más de la mitad de MC en múltiples sitios 66. El diagnóstico suele ser clínico y la biopsia está indicada en casos atípicos.
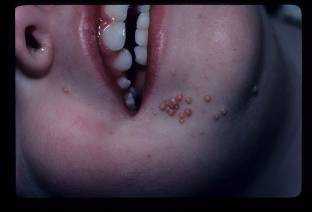
Figura 11. Molusco contagioso: múltiples pápulas umbilicadas periorificial.
La presentación de pápulas de color carne en las regiones genital, suprapúbica o perianal en un niño, el MC debe ser parte del diagnostico diferencial. Una vez diagnosticadas, existen varias opciones de tratamiento. Debido a que estas lesiones se resolverán solas, la espera vigilante es una opción. Puede que esta no sea una opción adecuada para algunas personas debido a las preferencias personales y el riesgo de propagación a los contactos cercanos. Los tratamientos tópicos que incluyen tretinoína, imiquimod y cidofovir. Los tratamientos más agresivos incluyen curetaje, crioterapia y cantarona (no disponible en los EE. UU.).31
Condyloma Accuminata (verrugas genitales)
Condyloma Accuminata (CA) son lesiones causadas por virus del papiloma humano (VPH). Es una infección extremadamente común en adultos y se está volviendo cada vez más común en la población pediátrica. Los modos de transmisión pueden incluir contacto vertical y sexual. El período de incubación para el virus puede variar de 1 a 20 meses.67 En los niños, la presentación más común son las verrugas perineales, que pueden evolucionar a lesiones cutáneas grandes con aspecto fúngico. Las lesiones vulvares son particularmente comunes. En casos seleccionados, las lesiones pueden volverse invasivas y destruir estructuras subyacentes.68 El diagnóstico puede ser clínico, pero si se necesita más certeza, se confirma con tinción inmunohistoquímica y tipificación de VPH.
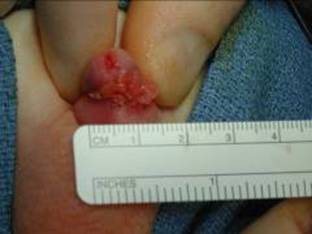
Figura 12. Verrugas genitales en dorso del pene.
La remisión espontánea es posible en pacientes pediátricos, aunque no se cree que sea lo habitual. Desafortunadamente, las múltiples terapias farmacológicas disponibles tienen tasas de mejoría deficientes y el condiloma tiene una tasa alta de recaída. En un estudio, los niños que no presentaron remisión espontánea dentro de los dos años tuvieron bajas tasas de remisión posterior y mala respuesta al tratamiento.67 Las opciones de tratamiento disponibles incluyen cimetidina, podofilina, crioterapia, electrocauterio y cantaradina.69 Los tratamientos que se centran en la destrucción epitelial se asocian con dolor y malestar. Las cremas como podofilox e imiquimod se asocian con una buena respuesta y menos irritación, pero aún se desconoce la eficacia a largo plazo.70 Otra opción terapéutica es la terapia fotodinámica con un 20% de gel de ácido 5-aminolaevulínico (ALA) y un láser de He-Ne. En un paciente de 9 años con lesiones vulvares, se observó resolución completa de las lesiones. Si bien este tratamiento es caro y se limita a verrugas externas, tiene como ventaja que es indoloro y no deja cicatrices.71
Trastornos cutáneos diversos
Pápulas del pene perlado
Las pápulas del pene nacarado son lesiones benignas que generalmente se encuentran cerca de la corona del pene y, ocasionalmente en el cuerpo. Las características de las lesiones son variadas, tienden a ser de 1 a 2 mm de ancho y de 1 a 4 mm de longitud. El color de las lesiones puede ser rosado, amarillo, blanco o translúcido. La mayoría de estas lesiones benignas se encuentran de forma incidental. En la mayoría de los casos son asintomáticas y se ven después de la pubertad. Histológicamente están relacionadas con los angiofibromas acrales.72
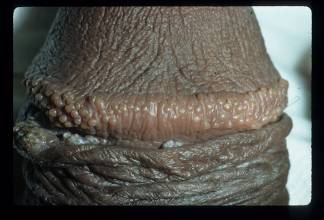
Figura 13. Pápulas del pene perlado.
La mayoría de los casos son diagnosticados después de la pubertad, se piensa que la incidencia de pápulas del pene perlado es extremadamente baja. La presentación es asintomática y similar a la de los adultos.73 En casos pediátricos, se debe considerar el molusco contagioso y el condiloma acuminado como diagnostico diferencial. El diagnóstico definitivo es con anatomía patológica. Otra opción es el uso de la dermatoscopía, que tiene la ventaja de ser no invasivo.74 El tratamiento de elección es la crioterapia y el láser de dióxido de carbono.72
Hemangiomas capilares
Los hemangiomas capilares, tanto las formas cutáneas como las cavernosas, son lesiones congénita comunes en la población pediátrica. Si bien se pueden encontrar en varios lugares, rara vez se asocian con los genitales o el área perianal. La mayoría de las lesiones cutáneas están asociadas con el glande.75 Cuando se encuentran estas lesiones, tienden a presentarse en los primeros dos años de vida con inflamación y molestias. Se describió un caso de hemangioma del glande que produjo una parafimosis.76
El diagnóstico de hemangioma incluye ecografía Doppler y biopsia, con la tinción requerida y el aislamiento del antígeno. El tratamiento es la escisión en bloque. Al resecar los hemangiomas cavernosos, es importante que el cirujano sea consciente de que pueden infiltrarse más profundamente de lo esperado.77 Cuando las lesiones son pequeñas, superficiales o ubicadas en áreas particularmente delicadas, la terapia con láser o escleroterapia son las terapias de elección es una opción.76,75.
Granuloma Anulare
Granuloma anulare es una afección benigna caracterizada por lesiones granulomatosas. Este es un proceso inflamatorio en el que la inflamación y la fibrosis rodean áreas de degeneración de colágeno. Estas lesiones pueden presentarse en cuatro formas: anular, generalizada, perforante y subcutánea. La forma subcutánea se observa con mayor frecuencia en la población pediátrica.78 Si bien es común que el granuloma anular afecte áreas sobre prominencias óseas, es raro que involucre los genitales. El granuloma anular de los genitales es asintomático, excepto por la angustia psicológica que puede impartir. El diagnóstico se realiza mediante biopsia. El tratamiento puede incluir escisión completa, esteroides intralesionales o manejo conservador.79
Neurofibroma
Los neurofibromas son tumores benignos de las células de Schwann (vainas nerviosas de los nervios periféricos y viscerales). Estaos tumores están asociadas con la enfermedad de von Recklinghausen, también conocida como neurofibromatosis. La forma de presentación es variada, desde pequeñas masas superficiales hasta tumores grandes que infiltran profundamente. Estas masas grandes y tortuosas se conocen como neurofibromas plexiformes y tienen riesgo malignizarse. Se pueden encontrar en todo el cuerpo siendo raro el compromiso genital.80,81
La afectación genital de los neurofibromas se puede encontrar en ambos sexos. Estas masas de tejido blando pueden afectar el pene, el escroto, los labios y el clítoris. El efecto de masa de los tumores puede llevar a semi-hipertrofia del pene, obstrucción de la uretra y clitoromegalia. Una fracción de los neurofibromas se extiende hacia la pelvis logrando contacto con la vejiga y el recto.82 El estudio debe ser con resonancia magnética para determinar el compromiso y planificar un adecuado abordaje quirúrgico. El tratamiento es la resección completa, si las estructuras cercanas impiden la escisión completa, se justifica la eliminación de parte de la masa tumoral. La resección parcial requiere un seguimiento frecuente con resonancia magnética debido al riesgo de malignidad futura.81
Un agradecimiento especial al Dr. Kenneth E Greer y al Dr. Craig A Peters por contribuir con imágenes.
Referencias
-
Akdis CA. Akdis M. Bieber T. Bindslev-Jensen C. Boguniewicz M. Eigenmann P et al. Diagnosis and treatment of atopic dermatitis in children and adults: European academy of allergology and clinical Immunology/American academy of allergy, asthma and Immunology/PRACTALL consensus report. Allergy 2006; 61: 969–87. ↩
-
Beltrani VS. The clinical spectrum of atopic dermatitis. Journal of Allergy & Clinical Immunology 1999; 104: S87–98. ↩
-
Katsarou A, Koufou V, Armenaka M, Kalogeromitros D, Papanayotou G, Vareltzidis A. Patch tests in children: A review of 14 years experience. Contact Dermatitis 1996; 34: 70–1. ↩
-
Sharma VK, Asati DP. Pediatric contact dermatitis. Indian J Dermatol Venereol Leprol 2010; 76: 514–20. ↩
-
Lauriola MM, De Bitonto A, Sena P. Allergic contact dermatitis due to cinnamon oil in galenic vaginal suppositories. Acta Derm Venereol 2010; 90: 187–8. ↩
-
Pullen SK, Warshaw EM. Vulvar allergic contact dermatitis from clotrimazole. Dermatitis 2010; 21: 59–60. ↩
-
Hanks JW, Venters WJ. Nickel allergy from a bed-wetting alarm confused with herpes genitalis and child abuse. Pediatrics 1992; 90: 458–60. ↩
-
Berg RW, Buckingham KW, Stewart RL. Etiologic factors in diaper dermatitis: The role of urine. Pediatr Dermatol 1986; 3: 102–6. ↩
-
Zimmerer RE, Lawson KD, Calvert CJ. The effects of wearing diapers on skin. Pediatr Dermatol 1986; 3: 95–101. ↩
-
Visscher MO, Chatterjee R, Munson KA, Bare DE, Hoath SB. Development of diaper rash in the newborn. Pediatr Dermatol 2000; 17: 52–7. ↩
-
Fiorillo L. Therapy of pediatric genital diseases. Dermatol Ther 2004; 17: 117–28. ↩
-
Leaute-Labreze C, Lamireau T, Chawki D, Maleville J, Taieb A. Diagnosis, classification, and management of erythema multiforme and stevens-johnson syndrome. Arch Dis Child 2000; 83: 347–52. ↩
-
Weston JA, Weston WL. The overdiagnosis of erythema multiforme. Pediatrics 1992; 89: 802. ↩
-
Osterne RL, Matos Brito RG, Pacheco IA, Alves AP, Sousa FB. Management of erythema multiforme associated with recurrent herpes infection: A case report. J Can Dent Assoc 2009; 75: 597–601. ↩ ↩2
-
Vanfleteren I, Van Gysel D, De Brandt C. Stevens-johnson syndrome: A diagnostic challenge in the absence of skin lesions. Pediatr Dermatol 2003; 20: 52–6. ↩
-
Murphy MI, Brant WE. Hematocolpos caused by genital bullous lesions in a patient with stevens-johnson syndrome. J Clin Ultrasound 1998; 26: 52–4. ↩
-
Smith GA, Sharma V, Knapp JF, Shields BJ. The summer penile syndrome: Seasonal acute hypersensitivity reaction caused by chigger bites on the penis. Pediatr Emerg Care 1998; 14: 116–8. ↩
-
Elston DM. Tick bites and skin rashes. Curr Opin Infect Dis 2010; 23: 132–8. ↩ ↩2
-
Kulthanan K, Wongkamchai S, Triwongwaranat D. Mosquito allergy: Clinical features and natural course. J Dermatol 2010; 37: 1025–31. ↩ ↩2
-
Jasaitiene D, Valiukeviciene S, Vaitkiene D, Jievaltas M, Barauskas V, Gudinaviciene I, et al. Lichen sclerosus et atrophicus in pediatric and adult male patients with congenital and acquired phimosis. Medicina (Kaunas) 2008; 44: 460–6. ↩
-
Kiss A, Kiraly L, Kutasy B, Merksz M. High incidence of balanitis xerotica obliterans in boys with phimosis: Prospective 10-year study. Pediatr Dermatol 2005; 22: 305–8. ↩ ↩2
-
Mallon E, Hawkins D, Dinneen M, Francics N, Fearfield L, Newson R, et al. Circumcision and genital dermatoses. Arch Dermatol 2000; 136: 350–4. ↩
-
Powell J, Wojnarowska F. Childhood vulval lichen sclerosus and sexual abuse are not mutually exclusive diagnoses. BMJ 2000; 320: 311. ↩
-
Powell J, Wojnarowska F. Childhood vulvar lichen sclerosus: An increasingly common problem. J Am Acad Dermatol 2001; 44: 803–6. ↩
-
Garzon MC, Paller AS. Ultrapotent topical corticosteroid treatment of childhood genital lichen sclerosus. Arch Dermatol 1999; 135: 525–8. ↩
-
Ebert AK, Rosch WH, Vogt T. Safety and tolerability of adjuvant topical tacrolimus treatment in boys with lichen sclerosus: A prospective phase 2 study. Eur Urol 2008; 54: 932–7. ↩
-
Steffens JA, Anheuser P, Treiyer AE, Reisch B, Malone PR. Plastic meatotomy for pure meatal stenosis in patients with lichen sclerosus. BJU Int 2010; 105: 568–72. ↩
-
Smith SD, Fischer G. Childhood onset vulvar lichen sclerosus does not resolve at puberty: A prospective case series. Pediatr Dermatol 2009; 26: 725–9. ↩
-
Meeuwis KA, de Hullu JA, de Jager ME, Massuger LF, van de Kerkhof PC, van Rossum MM. Genital psoriasis: A questionnaire-based survey on a concealed skin disease in the netherlands. J Eur Acad Dermatol Venereol 2010; 24: 1425–30. ↩
-
Fischer G. Chronic vulvitis in pre-pubertal girls. Australas J Dermatol 2010; 51: 118–23. ↩
-
Trager JD. What's your diagnosis? inflamed vulvar papules in a 7-year-old girl. J Pediatr Adolesc Gynecol 2005; 18: 179–82. ↩ ↩2 ↩3
-
Trager JD. What's your diagnosis? well-demarcated vulvar erythema in two girls. J Pediatr Adolesc Gynecol 2005; 18:43-6 ↩ ↩2
-
Lacarrubba F, Nasca MR, Micali G. Videodermatoscopy enhances diagnostic capability in psoriatic balanitis. J Am Acad Dermatol 2009; 61: 1084–6. ↩
-
Amichai B. Psoriasis of the glans penis in a child successfully treated with elidel (pimecrolimus) cream. J Eur Acad Dermatol Venereol 2004; 18: 742–3. ↩
-
Wu IB, Schwartz RA. Reiter's syndrome: The classic triad and more. J Am Acad Dermatol 2008; 59: 113–21. ↩
-
Zivony D, Nocton J, Wortmann D, Esterly N. Juvenile reiter's syndrome: A report of four cases. J Am Acad Dermatol 1998; 38: 32–7. ↩ ↩2
-
Manimegalai N, Rajamurugan PS, Rajendran CP, Rukmangatharajan S, Rajeshwari S, Ravichandran R, et al. Childhood reactive arthritis. J Clin Rheumatol 2008; 14: 292–3. ↩
-
Liang TC, Hsu CT, Yang YH, Lin YT, Chiang BL. Analysis of childhood reactive arthritis and comparison with juvenile idiopathic arthritis. Clin Rheumatol 2005; 24: 388–93. ↩
-
Morelli JG, Tay YK, Rogers M, Halbert A, Krafchik B, Weston WL. Fixed drug eruptions in children. J Pediatr 1999; 134: 365–7. ↩
-
Nussinovitch M, Prais D, Ben-Amitai D, Amir J, Volovitz B. Fixed drug eruption in the genital area in 15 boys. Pediatr Dermatol 2002; 19: 216–9. ↩ ↩2
-
Ozkaya-Bayazit E. Specific site involvement in fixed drug eruption. J Am Acad Dermatol 2003; 49: 1003–7. ↩
-
Lara-Corrales I, Pope E. Autoimmune blistering diseases in children. Semin Cutan Med Surg 2010; 29: 85–91. ↩
-
Fisler RE, Saeb M, Liang MG, Howard RM, McKee PH. Childhood bullous pemphigoid: A clinicopathologic study and review of the literature. Am J Dermatopathol 2003; 25: 183–9. ↩
-
Mirza M, Zamilpa I, Wilson JM. Localized penile bullous pemphigoid of childhood. J Pediatr Urol 2008; 4: 395–7. ↩ ↩2
-
Farrell AM, Kirtschig G, Dalziel KL, Allen J, Dootson G, Edwards S, et al. Childhood vulval pemphigoid: A clinical and immunopathological study of five patients. Br J Dermatol 1999; 140: 308–12. ↩ ↩2
-
Sugawara N, Nagai Y, Matsushima Y, Aoyama K, Ishikawa O. Infantile bullous pemphigoid treated with intravenous immunoglobulin therapy. J Am Acad Dermatol 2007; 57: 1084–9. ↩
-
Martel P, Joly P. Pemphigus: Autoimmune diseases of keratinocyte's adhesion molecules. Clin Dermatol 2001; 19: 662–74. ↩
-
Wananukul S, Pongprasit P. Childhood pemphigus. Int J Dermatol 1999; 38: 29–35. ↩
-
Yazganoglu KD, Baykal C, Kucukoglu R. Childhood pemphigus vulgaris: Five cases in 16 years. J Dermatol 2006; 33: 846–9. ↩
-
Sawamura D, Nakano H, Matsuzaki Y. Overview of epidermolysis bullosa. J Dermatol 2010; 37: 214–9. ↩
-
Fine JD, Johnson LB, Weiner M, Stein A, Cash S, DeLeoz J, et al. Genitourinary complications of inherited epidermolysis bullosa: Experience of the national epidermylosis bullosa registry and review of the literature. J Urol 2004; 172: 2040–4. ↩
-
Srinivasin A, Palmer LS. Genitourinary complications of epidermolysis bullosa. Urology 2007; 70:179.e5,179.e6. ↩
-
Donatucci CF, Berger TG, Deshon GE,Jr. Management of urinary tract in children with epidermolysis bullosa. Urology 1992; 40: 137–42. ↩
-
Marzano AV, Cugno M, Trevisan V, Fanoni D, Venegoni L, Berti E, et al. Role of inflammatory cells, cytokines and matrix metalloproteinases in neutrophil-mediated skin diseases. Clin Exp Immunol 2010; 162: 100–7. ↩ ↩2
-
Hadi A, Lebwohl M. Clinical features of pyoderma gangrenosum and current diagnostic trends. J Am Acad Dermatol 2011; 64: 950–4. ↩
-
Georgala S, Georgala C, Nicolaidou E. Pyoderma gangrenosum of the penis: A potentially dramatic skin disease. Urology 2008; 72:1185.e9,1185.10. ↩
-
Calamia KT, Wilson FC, Icen M, Crowson CS, Gabriel SE, Kremers HM. Epidemiology and clinical characteristics of behcet's disease in the US: A population-based study. Arthritis Rheum 2009; 61: 600–4. ↩
-
Kone-Paut I, Yurdakul S, Bahabri SA, Shafae N, Ozen S, Ozdogan H, et al. Clinical features of behcet's disease in children: An international collaborative study of 86 cases. J Pediatr 1998; 132: 721–5. ↩
-
de Carvalho VO, Abagge KT, Giraldi S, Kamoi TO, Assahide MK, Fillus Neto J, et al. Behcet disease in a child–emphasis on cutaneous manifestations. Pediatr Dermatol._ 2007; 24:E57-62. ↩ ↩2
-
Ozen S. Pediatric onset behcet disease. Curr Opin Rheumatol 2010; 22: 585–9. ↩
-
Yanar H, Taviloglu K, Ertekin C, Guloglu R, Zorba U, Cabioglu N, et al. Fournier's gangrene: Risk factors and strategies for management. World J Surg 2006; 30: 1750–4. ↩
-
Chen SY, Fu JP, Wang CH, Lee TP, Chen SG. Fournier gangrene: A review of 41 patients and strategies for reconstruction. Ann Plast Surg 2010; 64: 765–9. ↩ ↩2
-
Ekingen G, Isken T, Agir H, Oncel S, Gunlemez A. Fournier's gangrene in childhood: A report of 3 infant patients. J Pediatr Surg 2008; 43:e39-42. ↩ ↩2
-
Jefferies M, Saw NK, Jones P. Fournier's gangrene in a five year old boy - beware of the child post varicella infection. Ann R Coll Surg Engl 2010; 92:W62-3. ↩
-
Tyring SK. Molluscum contagiosum: The importance of early diagnosis and treatment. Am J Obstet Gynecol 2003; 189: S12-6. ↩
-
Dohil MA, Lin P, Lee J, Lucky AW, Paller AS, Eichenfield LF. The epidemiology of molluscum contagiosum in children. J Am Acad Dermatol 2006; 54: 47–54. ↩
-
Allen AL, Siegfried EC. The natural history of condyloma in children. J Am Acad Dermatol 1998; 39: 951–5. ↩ ↩2
-
Gor RA, Schober JM. Giant condyloma with demise secondary to meningococcemia in an infant boy. J Pediatr Urol 2009; 5: 327–9. ↩
-
von Krogh G, Szpak E, Andersson M, Bergelin I. Self-treatment using 0.25%-0.50% podophyllotoxin-ethanol solutions against penile condylomata acuminata: A placebo-controlled comparative study. Genitourin Med 1994; 70: 105–9. ↩
-
Moresi JM, Herbert CR, Cohen BA. Treatment of anogenital warts in children with topical 0.05% podofilox gel and 5% imiquimod cream. Pediatr Dermatol 2001; 18: 448–50; discussion 452. ↩
-
Chen M, Xie J, Han J. Photodynamic therapy of condyloma acuminatum in a child. Pediatr Dermatol 2010; 27: 542–4. ↩
-
Agrawal SK, Bhattacharya SN, Singh N. Pearly penile papules: A review. Int J Dermatol 2004; 43: 199–201. ↩ ↩2
-
Neri I, Bardazzi F, Raone B, Negosanti M, Patrizi A. Ectopic pearly penile papules: A paediatric case. Genitourin Med 1997; 73:136. ↩
-
Ozeki M, Saito R, Tanaka M. Dermoscopic features of pearly penile papules. Dermatology 2008; 217: 21–2. ↩
-
Tsujii T, Iwai T, Inoue Y, Kubota T, Kihara K, Oshima H. Cutaneous hemangioma of the penis successfully treated with sclerotherapy and ligation. Int J Urol 1998; 5: 396–7. ↩ ↩2
-
Yigiter M, Arda IS, Hicsonmez A. An unusual cause of paraphimosis: Hemangioma of the glans penis. J Pediatr Surg 2008; 43:e31-3. ↩ ↩2
-
Ferrer FA, McKenna PH. Cavernous hemangioma of the scrotum: A rare benign genital tumor of childhood. J Urol 1995; 153: 1262–4. ↩
-
Forman SB, Sumfest JM, Pride HB, Ferringer TC. Penile granuloma annulare of an adolescent male–case report and review of the literature. Pediatr Dermatol 2008; 25: 260–2. ↩
-
Sidwell RU, Green JS, Agnew K, Francis ND, Roberts NM, Yates VM, et al. Subcutaneous granuloma annulare of the penis in 2 adolescents. J Pediatr Surg 2005; 40: 1329–31. ↩
-
Littlejohn JO, Belman AB, Selby D. Plexiform neurofibroma of the penis in a child. Urology 2000; 56: 669. ↩
-
Mazdak H, Gharaati MR. Plexiform neurofibroma of penis. Urol J 2007; 4: 52–4. ↩ ↩2
-
Pascual-Castroviejo I, Lopez-Pereira P, Savasta S, Lopez-Gutierrez JC, Lago CM, Cisternino M. Neurofibromatosis type 1 with external genitalia involvement presentation of 4 patients. J Pediatr Surg 2008; 43: 1998–2003. ↩









